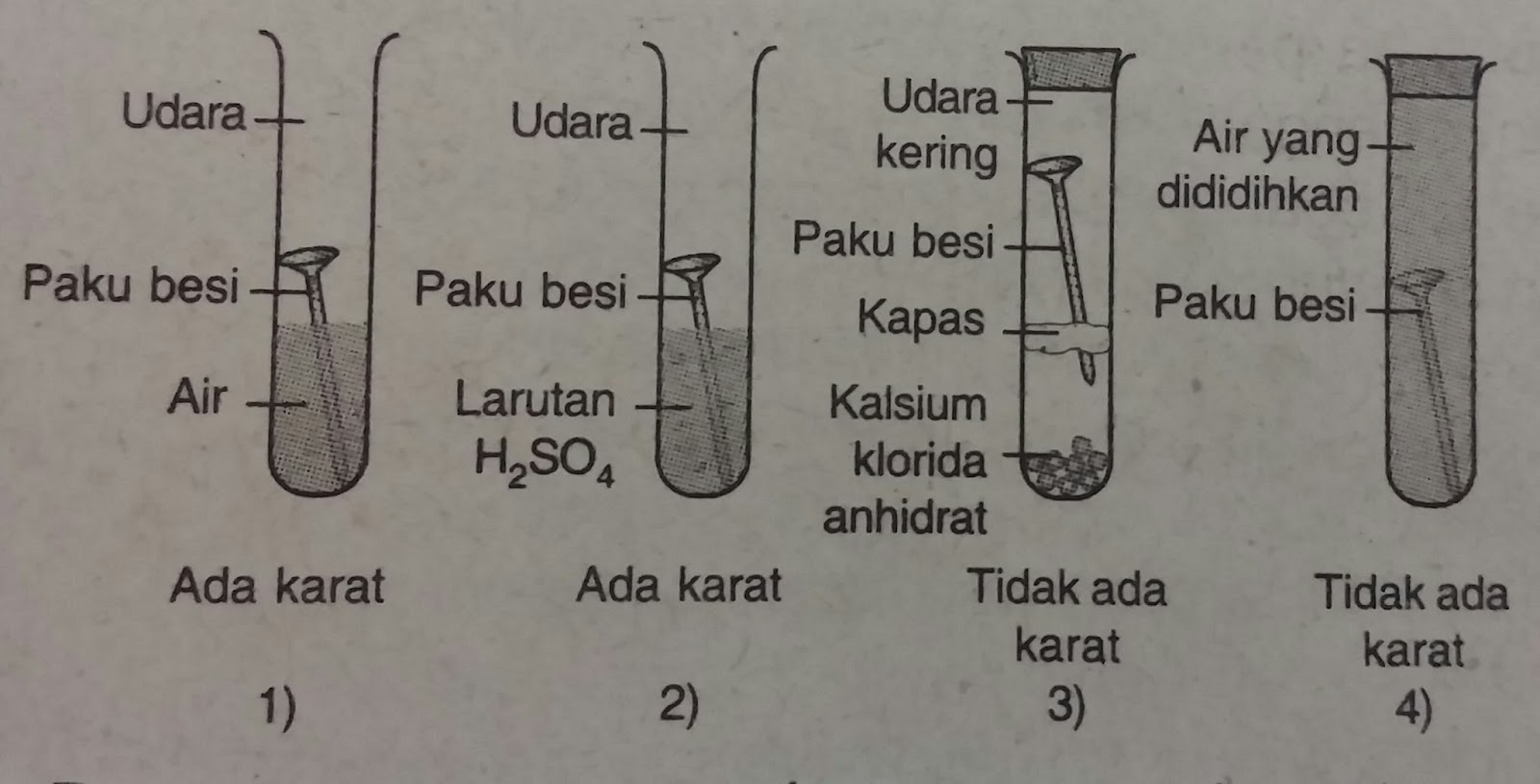
Rumus mencari h dari penyangga asam.
Jika kamu mencari artikel rumus mencari h dari penyangga asam terbaru, berarti kamu telah berada di web yang benar. Yuk langsung saja kita simak penjelasan rumus mencari h dari penyangga asam berikut ini.
 Jenis, 24 jam, Hours, Perlis, Kedah, Perak, Langkawi From sewa-lori.com
Jenis, 24 jam, Hours, Perlis, Kedah, Perak, Langkawi From sewa-lori.com
Tinggal masukin ke rumus, karena yang bersisa asam lemah dan basa konjugasi dari garam, maka hasil reaksi membentuk larutan penyangga, masuk.
Rumus ph campuran larutan dengan sisa larutan asam/basa lemah (dapar/penyangga/buffer). Hitung ph dan kapasitas bufer dari larutan bufer yang dibuat dengan campuran 100 ml naoh 0,10 m dan 135 ml hc 2 h 3 o 2 0,30 m. Cara menghitung ph larutan telah dijelaskan sebelumnya bahwa sifat asam suatu larutan ditentukan oleh adanya ion h + yang ada pada senyawa ketika dilarutkan dalam air. Asam asetat atau acetic acid atau ethanoic acid adalah senyawa organik. Rumus larutan penyangga basa :
 Source: sewa-lori.com
Source: sewa-lori.com
Tentukan harga ph larutan 0,01m hcl! Jika ar o = 16 dan s = 32,. Jadi ph larutan buffer yang dibuat dari 1 m asam asetat dan 1 m natrium asetat yaitu sebesar 4.75. Lalu senyawa asam laktat tersebut diukur ph nya dengan menggunkan ph meter digital. Reaksi ionisasi asam sulfat h 2 so 4.
Tentukan ph dari suatu larutan yang memiliki konsentrasi ion h + sebesar 2 × 10 −4 m.
Jadi ph larutan buffer yang dibuat dari 1 m asam asetat dan 1 m natrium asetat yaitu sebesar 4.75. Menghitung jumlah mol (n) nh 3 awal: [h 2 so 4] = 0,05 m. Tanpa basa pahit lagi kuy kita masuk saja kematerinya !
 Source: sewa-lori.com
Source: sewa-lori.com
Jika didefinisikan secara matematis, ph merupakan logaritma negatif dari konsentrasi ion hidrogen yang ada pada larutan. Setelah diketahui konsentrasi h +, maka ph dapat dihitung dengan rumus:. Ph = derajat keasaman [h +] = molaritas ion h + (m) Karena dalam konsep reaksi kesetimbangan asam tidak seperti itu.
 Source: sewa-lori.com
Source: sewa-lori.com
Asam cuka memiliki rumus kimia yaitu ch3cooh, asam asetat murni. Dalam pendeteksian ini, ada beberapa alat yang dapat digunakan. Nilai ph larutan asam basa diperoleh sebagai hasil negatif logaritma 10 dari molaritas ion h +. Pk a hc 2 h 3 o 2 = 4,74.
 Source: ilmusosial.id
Source: ilmusosial.id
Tinggal masukin ke rumus, karena yang bersisa asam lemah dan basa konjugasi dari garam, maka hasil reaksi membentuk larutan penyangga, masuk. Prinsip kerja larutan penyangga buffer. Setelah diketahui konsentrasi h +, maka ph dapat dihitung dengan rumus:. Hitung ph dan kapasitas bufer dari larutan bufer yang dibuat dengan campuran 100 ml naoh 0,10 m dan 135 ml hc 2 h 3 o 2 0,30 m.
Mgrek ch3cooh ~ mgrek naoh.
Menghitung ph larutan atau poh larutan. Karena dalam konsep reaksi kesetimbangan asam tidak seperti itu. Setelah diketahui konsentrasi h +, maka ph dapat dihitung dengan rumus:. Larutan penyangga basa dapat diperoleh dengan mencampur basa lemah dengan garamnya atau basa lemah berlebih dengan asam kuat. Mgrek ch3cooh ~ mgrek naoh.
 Source: sewa-lori.com
Source: sewa-lori.com
Tanpa basa pahit lagi kuy kita masuk saja kematerinya ! Karena dalam konsep reaksi kesetimbangan asam tidak seperti itu. Asam yang sedikit menghasilkan ion h + disebut asam lemah.senyawa asam lemah merupakan elektrolit lemah sehingga di dalam air dapat terionisasi sebagian , tetapi tidak sempurna. Setelah diketahui konsentrasi h +, maka ph dapat dihitung dengan rumus:. Asam asetat adalah asam yang relatif lemah.
Ph merupakan kepanjangan dari power of hydrogen.
Di dalam tabung erlenmeyer, terdapat senyawa asam laktat yang memiliki konsentrasi 2 m. Jika ar o = 16 dan s = 32,. Gunakan nilai log 2 = 0,3. Setelah diketahui konsentrasi h +, maka ph dapat dihitung dengan rumus:.
 Source: sewa-lori.com
Source: sewa-lori.com
Nilai ph larutan asam basa diperoleh sebagai hasil negatif logaritma 10 dari molaritas ion h +. Setelah diketahui konsentrasi h +, maka ph dapat dihitung dengan rumus:. Larutan penyangga basa berasal dari basa lemah dan asam konjugasinya. Dalam pendeteksian ini, ada beberapa alat yang dapat digunakan.
 Source: sewa-lori.com
Source: sewa-lori.com
Hitung ph dan kapasitas bufer dari larutan bufer yang dibuat dengan campuran 100 ml naoh 0,10 m dan 135 ml hc 2 h 3 o 2 0,30 m. Mgrek ch3cooh ~ mgrek naoh. Menentukan perubahan entalpi (δh) : Sekilas banyak yang menduga bahwa untuk menentukan ph campuran asam kuat dengan asam lemah tinggal menghitung [h +] setiap asam dan menjumlahkan keduanya kemudian menghitung ph dari [h +] campuran itu.ternyata ini tidak benar.
 Source: ilmusosial.id
Source: ilmusosial.id
Menghitung ph larutan penyangga dengan menambahkan sedikit asam atau sedikit basa atau. [h 2 so 4] = 0,05 m. Cara menghitung ph larutan telah dijelaskan sebelumnya bahwa sifat asam suatu larutan ditentukan oleh adanya ion h + yang ada pada senyawa ketika dilarutkan dalam air. Larutan penyangga yang bersifat asam.
Larutan penyangga basa berasal dari basa lemah dan asam konjugasinya.
Setelah diketahui konsentrasi h +, maka ph dapat dihitung dengan rumus:. Gunakan nilai log 2 = 0,3. Hitung ph dan kapasitas bufer dari larutan bufer yang dibuat dengan campuran 100 ml naoh 0,10 m dan 135 ml hc 2 h 3 o 2 0,30 m. Nilai ph larutan asam basa diperoleh sebagai hasil negatif logaritma 10 dari molaritas ion h +. [h +] = 10 −4, dengan rumus yang pertama untuk mencari ph.
 Source: sewa-lori.com
Source: sewa-lori.com
Dengan demikian, tingkat keasaman suatu larutan tergantung pada konsentrasi ion. Hitung ph dan kapasitas bufer dari larutan bufer yang dibuat dengan campuran 100 ml naoh 0,10 m dan 135 ml hc 2 h 3 o 2 0,30 m. Menentukan perubahan entalpi (δh) : Menghitung ph larutan atau poh larutan. Pk a hc 2 h 3 o 2 = 4,74.
Menghitung jumlah mol (n) nh 3 awal:
Menghitung ph larutan atau poh larutan. Karena dalam konsep reaksi kesetimbangan asam tidak seperti itu. Agar kalian tahu lebih jelas tentang alat itu, simak penjelasan. Untuk mencari tetapan ionisasi dari suatu asam atau basa lemah kita bisa menggunakan rumus berikut.
 Source: ilmusosial.id
Source: ilmusosial.id
Tanpa basa pahit lagi kuy kita masuk saja kematerinya ! Jika ar o = 16 dan s = 32,. Ph = derajat keasaman [h +] = molaritas ion h + (m) Dibawah ini penjelasan mengenai rumus, cara dan contoh soal menentukan perubahan entalpi.
 Source: sewa-lori.com
Source: sewa-lori.com
[h +] = 10 −4, dengan rumus yang pertama untuk mencari ph. Jdi untuk mencari konsentrasi (m) cukup pakai m total. Agar kalian tahu lebih jelas tentang alat itu, simak penjelasan. Jika didefinisikan secara matematis, ph merupakan logaritma negatif dari konsentrasi ion hidrogen yang ada pada larutan.
 Source: sewa-lori.com
Source: sewa-lori.com
Reaksi ionisasi asam sulfat h 2 so 4 dapat dinyatakan dengan persamaan reaksi berikut. Hal ini terjadi karena konsentrasi ion h+ dari asam kuat jauh lebih banyak dibandingkan konsentrasi ion h+ dari asam lemah. Lalu senyawa asam laktat tersebut diukur ph nya dengan menggunkan ph meter digital. Rumus ph campuran larutan dengan sisa larutan asam/basa lemah (dapar/penyangga/buffer).
Tinggal masukin ke rumus, karena yang bersisa asam lemah dan basa konjugasi dari garam, maka hasil reaksi membentuk larutan penyangga, masuk.
Hal ini terjadi karena konsentrasi ion h+ dari asam kuat jauh lebih banyak dibandingkan konsentrasi ion h+ dari asam lemah. Dibawah ini penjelasan mengenai rumus, cara dan contoh soal menentukan perubahan entalpi. Hitung perubahan ph ketika 0,001 m hcl ditambahkan ke dalam campuran tadi. Setelah diketahui konsentrasi h +, maka ph dapat dihitung dengan rumus:. Lalu senyawa asam laktat tersebut diukur ph nya dengan menggunkan ph meter digital.
 Source: sewa-lori.com
Source: sewa-lori.com
Contoh soal larutan penyangga lain yang bisa kalian simak mengenai cara menghitung ph : Nilai ph larutan asam basa diperoleh sebagai hasil negatif logaritma 10 dari molaritas ion h +. Asam asetat atau acetic acid atau ethanoic acid adalah senyawa organik. Nanti m totalnya d masukkan ke rumus ph asam lemah. [h 2 so 4] = 0,05 m.
Hal ini terjadi karena konsentrasi ion h+ dari asam kuat jauh lebih banyak dibandingkan konsentrasi ion h+ dari asam lemah.
Menghitung ph larutan atau poh larutan. Jdi untuk mencari konsentrasi (m) cukup pakai m total. Prinsip kerja larutan penyangga buffer. Mgrek ch3cooh ~ mgrek naoh.
 Source: sewa-lori.com
Source: sewa-lori.com
Reaksi ionisasi asam sulfat h 2 so 4 dapat dinyatakan dengan persamaan reaksi berikut. Untuk menghitung rumus asam kuat : Rumus larutan penyangga basa : Pk a hc 2 h 3 o 2 = 4,74. Larutan penyangga yang bersifat asam.
 Source: ilmusosial.id
Source: ilmusosial.id
Larutan penyangga basa berasal dari basa lemah dan asam konjugasinya. Dibawah ini penjelasan mengenai rumus, cara dan contoh soal menentukan perubahan entalpi. Nilai ph larutan asam basa diperoleh sebagai hasil negatif logaritma 10 dari molaritas ion h +. Di dalam tabung erlenmeyer, terdapat senyawa asam laktat yang memiliki konsentrasi 2 m. Tanpa basa pahit lagi kuy kita masuk saja kematerinya !
 Source: sewa-lori.com
Source: sewa-lori.com
Tanpa basa pahit lagi kuy kita masuk saja kematerinya ! Hitung ph dan kapasitas bufer dari larutan bufer yang dibuat dengan campuran 100 ml naoh 0,10 m dan 135 ml hc 2 h 3 o 2 0,30 m. [h 2 so 4] = 0,05 m. Nilai ph larutan asam basa diperoleh sebagai hasil negatif logaritma 10 dari molaritas ion h +. Pk a hc 2 h 3 o 2 = 4,74.
Situs ini adalah komunitas terbuka bagi pengguna untuk berbagi apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini bermanfaat, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul rumus mencari h dari penyangga asam dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.