Pengertian oksidasi dan reduksi berdasarkan serah terima elektron.
Jika kamu mencari artikel pengertian oksidasi dan reduksi berdasarkan serah terima elektron terlengkap, berarti kamu telah berada di web yang benar. Yuk langsung aja kita simak pembahasan pengertian oksidasi dan reduksi berdasarkan serah terima elektron berikut ini.
 Reaksi reduksi oksidasi (melani punya) From es.slideshare.net
Reaksi reduksi oksidasi (melani punya) From es.slideshare.net
Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi.
Konsep redoks berdasarkan serah terima elektron a. Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi. Reaksi reduksi adalah reaksi pelepasan oksigen dari suatu zat. Reduksi adalah peristiwa pengikatan elektron. 6co 2 + 6h 2 o → c 6 h 12 o 6 + 6o 2.
 Source: es.slideshare.net
Source: es.slideshare.net
Oksidasi adalah peristiwa penerimaan electron.sedangkan reduksi adalah peristiwa pelepasan electron. Konsep reaksi oksidasi dan reduksi berdasarkan pelepasan dan penangkapan elektron. Redoks merupakan singkatan dari reaksi reduksi dan oksidasi. Reduksi adalah peristiwa suatu atom menerima elektronoksidasi adalah peristiwa suatu atom melepaskan elektronadapun dibawah ini terdapat bberapa aturan mengenai batasan bilangan oksidasi. Reaksi dimana salah satu zat menangkap elektron yang dilepas zat lain.
Konsep redoks berdasarkan pengikatan dan pelepasan oksigen.
Reaksi oksidasi reduksi ditinjau dari serah terima elektron. Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi. Jadi pada reaksinya ada sejumlah elektron yang terlibat pada reaktan. Reaksi redok adalah suatu reaksi serah terima elektron dan reaksi yang disertai perubahan bilangan oksidasi disebut reaksi redoks.
 Source: es.slideshare.net
Source: es.slideshare.net
Konsep reaksi oksidasi dan reduksi berdasarkan pelepasan dan penangkapan elektron. Reaksi oksidasi dan reduksi ternyata bukan hanya melibatkan oksigen, melainkan juga melibatkan elektron. Reaksi reduksi adalah reaksi pelepasan oksigen dari suatu zat. Fe 2 o 3 + 3co → 2fe + 3co 2.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Reduktor adalah zat yang menarik oksigen pada reaksi reduksi, dari contoh diatas yang merupakan oksidator adalah co dan h2. Dari reaksi diatas, cl 2 mengalami oksidasi dan reduksi Menurut konsep pengikatan dan pelepasan elektron pengertian reduksi adalah zat/spesi yang mengikat elektron. Konsep reaksi oksidasi dan reduksi berdasarkan pelepasan dan penangkapan elektron.
Redoks adalah peristiwa yang melibatkan transfer elektron atau serah terima elektron.redoks terdiri dari reaksi oksidasi dan reaksi reduksi.
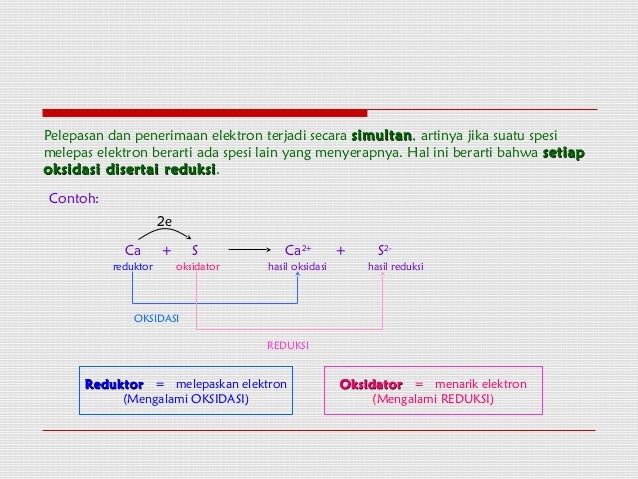
Redoks berdasarkan serah terima elektron. Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan). Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi. Reduksi adalah peristiwa pengikatan elektron. Oksidasi adalah reaksi pelepasan oksigen.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Na → na + + ē (na melepas 1 elektron) Berdasarkan gambar di atas : Reaksi oksidasi adalah reaksi pelepasan elektron, sedangkan reduksi adalah reaksi penangkapan elektron. Oksidasi adalah peristiwa pelepasan elektron. Bisa kamu perhatikan gambar di atas ya, pada reaksi reduksi, elektronnya berada di ruas sebelah kiri reaksi, sebagai reaktan.
Redoks adalah peristiwa yang melibatkan transfer elektron atau serah terima elektron.redoks terdiri dari reaksi oksidasi dan reaksi reduksi.
Reaksi oksidasi adalah reaksi pelepasan elektron. Redoks adalah peristiwa yang melibatkan transfer elektron atau serah terima elektron.redoks terdiri dari reaksi oksidasi dan reaksi reduksi. Berdasarkan pelepasan dan pengikatan electron (serah terima elektron). Ada 3 konsep yang menjelaskan mengenai oksidasi dan reduksi yaitu berdasarkan pengikatan dan pelepasan oksigen, berdasarkan penerimaan dan pelepasan electron dan yang terakhir berdasarkan kenaikan dan penurunan bilangan oksidasi.
 Source: es.slideshare.net
Source: es.slideshare.net
Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi. Jadi pada reaksinya ada sejumlah elektron yang terlibat pada reaktan. Reaksi redoks tidak hanya berlaku pada senyawa ion tetapi juga pada senyawa kovalen. Berdasarkan perpindahan (transfer) elektron, reaksi reduksi adalah reaksi penangkapan elektron, sedangkan reaksi oksidasi adalah reaksi pelepasan elektron.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Reaksi redok adalah suatu reaksi serah terima elektron dan reaksi yang disertai perubahan bilangan oksidasi disebut reaksi redoks. Reaksi redoks ini dijelaskan dengan mekanisme serah terima elektron, yaitu sebagai berikut. Menurut konsep pengikatan dan pelepasan elektron pengertian reduksi adalah zat/spesi yang mengikat elektron. Berdasarkan pelepasan dan pengikatan electron (serah terima elektron).
Dari reaksi diatas, cl 2 mengalami oksidasi dan reduksi
Reaksi dimana salah satu zat menangkap elektron yang dilepas zat lain. Fe 2 o 3 + 3co → 2fe + 3co 2. Reaksi dimana salah satu zat menangkap elektron yang dilepas zat lain. Redoks adalah peristiwa yang melibatkan transfer elektron atau serah terima elektron.redoks terdiri dari reaksi oksidasi dan reaksi reduksi. Apa pengertian oksidasi, reduksi, reduktor dan oksidator berdasarkan pada penerimaan dan pelepasan electron, pahami contoh berikut!
 Source: es.slideshare.net
Source: es.slideshare.net
Berdasarkan gambar di atas : Pengertian redoks berdasarkan naik turunnya bilangan oksidasi merupakan pengembangan dari pengertian redoks berdasarkan serah terima elektron. Reduksi adalah reaksi pengikatan (menerima) elektron. Redoks berdasarkan serah terima elektron. Berdasarkan perpindahan (transfer) elektron, reaksi reduksi adalah reaksi penangkapan elektron, sedangkan reaksi oksidasi adalah reaksi pelepasan elektron.
Reaksi oksidasi adalah reaksi pelepasan elektron.
Reaksi oksidasi dan reduksi ternyata bukan hanya melibatkan oksigen, melainkan juga melibatkan elektron. Oksidasi adalah reaksi pelepasan oksigen. Reaksi oksidasi adalah reaksi pelepasan elektron, sedangkan reduksi adalah reaksi penangkapan elektron. Redoks berdasarkan serah terima elektron.
 Source: es.slideshare.net
Source: es.slideshare.net
Reaksi oksidasi reduksi ditinjau dari serah terima elektron. Ada 3 konsep yang menjelaskan mengenai oksidasi dan reduksi yaitu berdasarkan pengikatan dan pelepasan oksigen, berdasarkan penerimaan dan pelepasan electron dan yang terakhir berdasarkan kenaikan dan penurunan bilangan oksidasi. Oksidasi adalah reaksi pelepasan oksigen. Apa itu reduksi dan oksidasi ?
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Reduksi adalah peristiwa pengikatan elektron. Reaksi redok adalah suatu reaksi serah terima elektron dan reaksi yang disertai perubahan bilangan oksidasi disebut reaksi redoks. Reduksi adalah reaksi pengikatan (menerima) elektron. Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan).
Pengertian redoks berdasarkan naik turunnya bilangan oksidasi merupakan pengembangan dari pengertian redoks berdasarkan serah terima elektron.
Konsep reaksi oksidasi dan reduksi berdasarkan pelepasan dan penangkapan elektron. Konsep reaksi oksidasi dan reduksi berdasarkan pelepasan dan penangkapan elektron. Oksidasi adalah reaksi pelepasan oksigen. Reaksi serah/ pelepasan dan terima/ penangkapan elektron reaksi reduksi oksidasi dapat dipandang sebagai reaksi yang berlangsung dengan mekanisme serah terima elektron. Berdasarkan pengikatan dan pelepasan elektron.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Redoks berdasarkan serah terima elektron. Reaksi oksidasi adalah reaksi pelepasan elektron, sedangkan reduksi adalah reaksi penangkapan elektron. Oksidasi adalah peristiwa penerimaan electron.sedangkan reduksi adalah peristiwa pelepasan electron. Reaski oksidasi adalah reaksi pelepasan elektron dari suatu zat contoh : Berdasarkan perpindahan (transfer) elektron, reaksi reduksi adalah reaksi penangkapan elektron, sedangkan reaksi oksidasi adalah reaksi pelepasan elektron.
Konsep redoks berdasarkan perubahan biloks.
Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi. Reduksi adalah peristiwa suatu atom menerima elektronoksidasi adalah peristiwa suatu atom melepaskan elektronadapun dibawah ini terdapat bberapa aturan mengenai batasan bilangan oksidasi. Reduktor adalah zat yang menarik oksigen pada reaksi reduksi, dari contoh diatas yang merupakan oksidator adalah co dan h2. Konsep redoks berdasarkan serah terima elektron a.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Dari reaksi diatas, cl 2 mengalami oksidasi dan reduksi Reaksi serah/ pelepasan dan terima/ penangkapan elektron reaksi reduksi oksidasi dapat dipandang sebagai reaksi yang berlangsung dengan mekanisme serah terima elektron. Dari reaksi diatas, cl 2 mengalami oksidasi dan reduksi Konsep reaksi oksidasi dan reduksi berdasarkan pelepasan dan penangkapan elektron. Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan).
 Source: es.slideshare.net
Source: es.slideshare.net
Redoks merupakan singkatan dari reaksi reduksi dan oksidasi. Apa pengertian oksidasi, reduksi, reduktor dan oksidator berdasarkan pada penerimaan dan pelepasan electron, pahami contoh berikut! Reduksi adalah peristiwa pengikatan elektron. Reaksi oksidasi adalah reaksi pelepasan elektron, sedangkan reduksi adalah reaksi penangkapan elektron. Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan).
Situs ini adalah komunitas terbuka bagi pengguna untuk membagikan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini baik, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul pengertian oksidasi dan reduksi berdasarkan serah terima elektron dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.





