Pengertian laju reaksi dan orde reaksi.
Jika kamu sedang mencari artikel pengertian laju reaksi dan orde reaksi terbaru, berarti kamu sudah berada di website yang tepat. Yuk langsung saja kita simak penjelasan pengertian laju reaksi dan orde reaksi berikut ini.
 Bentuk Molekul dengan Pendekatan teori VSEPR From perpustakaancyber.blogspot.com
Bentuk Molekul dengan Pendekatan teori VSEPR From perpustakaancyber.blogspot.com
[h 2] [no 2] 2, reaksi tersebut mempunyai tingkat (atau orde) pertama terhadap h 2 dan tingkat (atau orde) kedua terhadap no.
Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. Laju reaksi adalah perbandingan perubahan konsentrasi pereaksi atau hasil reaksi terhadap perubahan waktu, yakni pada reaksi : Orde ini tidak bergantung pada koefisien stoikiometri reaktan, tetapi tergantung pada nilai selama eksperimen. Lks kurikulum 2013 orde dan persamaan laju reaksi. About press copyright contact us creators advertise developers terms privacy policy & safety how youtube works test new features press copyright contact us creators.
 Source: perpustakaancyber.blogspot.com
Source: perpustakaancyber.blogspot.com
Orde ini tidak bergantung pada koefisien stoikiometri reaktan, tetapi tergantung pada nilai selama eksperimen. Orde keseluruhan reaksi merupakan penjumlahan orde semua komponennya. M= tingkat reaksi (orde reaksi) terhadap a. Orde reaksi dan persamaan laju reaksi. Dengan r = laju reaksi, k = tetapan laju reaksi, dan m/n = orde (tingkat) reaksi pada pereaksi a/b.
Orde keseluruhan reaksi merupakan penjumlahan orde semua komponennya.
Coba kamu perhatikan rumusnya, selain ada tetapan laju reaksi, juga ada orde reaksi. Sebagai contoh, v = k [a]m [b]n, bila m=1 kita katakan bahwa reaksi tersebut adalah orde pertama terhadap a. Menentukan orde reaksi berdasarkan analisis data yang diperoleh melalui percobaan menentukan persamaan laju. Dari situ dapat ditarik kesimpulan mengenai mekanisme reaksi.
 Source: perpustakaancyber.blogspot.com
Source: perpustakaancyber.blogspot.com
Pengertian laju reaksi adalah suatu perubahan konsentrasi zat dalam suatu reaksi kimia per satuan waktu.laju reaksi ini dipengaruhi oleh beberapa faktor yaitu sifat kimia pereaksi, konsentrasi pereaksi, suhu, luas permukaan sentuh, katalis dan tekanan. Orde reaksi di sini berbeda dengan koefisien stoikiometrinya. Laju menyatakan seberapa cepat atau seberapa lambat suatu proses berlangsung. A dan b adalah zat pereaksi/reaktan, sehingga [a] = konsentrasi zat a dan [b] = konsentrasi zat b.
 Source: rumuskimia.net
Source: rumuskimia.net
Orde ini tidak bergantung pada koefisien stoikiometri reaktan, tetapi tergantung pada nilai selama eksperimen. Menentukan orde reaksi berdasarkan analisis data yang diperoleh melalui percobaan menentukan persamaan laju. About press copyright contact us creators advertise developers terms privacy policy & safety how youtube works test new features press copyright contact us creators. Persamaan seperti di atas, disebut persamaan laju reaksi atau hukum laju reaksi.
 Source: nafiun.com
Source: nafiun.com
Persamaan laju reaksinya adalah r = k[hgcl2]1[c2o42−]2 dalam contoh ini, orde reaksi reaktan hgcl2 adalah 1 dan orde reaksi ion oksalat adalah 2; Mudahnya, orde reaksi itu adalah tingkat reaksi. Laju perubahan reaktan muncul dengan tanda negatif dan laju perubahan produk dengan tanda positif. Laju juga menyatakan besarnya perubahan yang terjadi dalam satu.
K = tetapan laju reaksi.
Pengertian laju reaksi adalah suatu perubahan konsentrasi zat dalam suatu reaksi kimia per satuan waktu.laju reaksi ini dipengaruhi oleh beberapa faktor yaitu sifat kimia pereaksi, konsentrasi pereaksi, suhu, luas permukaan sentuh, katalis dan tekanan. Dengan r = laju reaksi, k = tetapan laju reaksi, dan m/n = orde (tingkat) reaksi pada pereaksi a/b. Orde reaksi (kebanyakan) bilangan bulat, tetapi juga bisa dalam bentuk pecahan dan bilangan negatif. Orde reaksi di sini berbeda dengan koefisien stoikiometrinya. Menentukan orde reaksi berdasarkan analisis data yang diperoleh melalui percobaan menentukan persamaan laju.
 Source: perpustakaancyber.blogspot.com
Source: perpustakaancyber.blogspot.com
Pengertian , rumus dan contoh soal laju reaksi. Dari situ dapat ditarik kesimpulan mengenai mekanisme reaksi. Coba kamu perhatikan rumusnya, selain ada tetapan laju reaksi, juga ada orde reaksi. About press copyright contact us creators advertise developers terms privacy policy & safety how youtube works test new features press copyright contact us creators. Orde reaksi di sini berbeda dengan koefisien stoikiometrinya.
Orde reaksi itu merupakan pangkat molaritas dalam persamaan laju reaksi.
Untuk reaksi aa + bb → cc + dd, persamaan laju reaksi ditulis: Persamaan laju reaksi diperoleh dari hasil percobaan/eksperiman yang secara umum memiliki persamaan r = k[a] m [b] n. Dekomposisi hi menjadi h 2 dan i 2 pada permukaan emas merupakan reaksi orde 0 terhadap hi. Laju menyatakan seberapa cepat atau seberapa lambat suatu proses berlangsung.
 Source: rumuskimia.net
Source: rumuskimia.net
Persamaan seperti di atas, disebut persamaan laju reaksi atau hukum laju reaksi. Orde reaksi dan persamaan laju reaksi. Dengan r = laju reaksi, k = tetapan laju reaksi, dan m/n = orde (tingkat) reaksi pada pereaksi a/b. K = tetapan laju reaksi.
 Source: perpustakaancyber.blogspot.com
Source: perpustakaancyber.blogspot.com
Orde reaksi di sini berbeda dengan koefisien stoikiometrinya. Orde reaksi (kebanyakan) bilangan bulat, tetapi juga bisa dalam bentuk pecahan dan bilangan negatif. Orde reaksi hanya bisa ditentukan lewat percobaan. Contohnya, reaksi dengan hukum laju persamaan v = k [ a ] [ b] merupakan orde pertama dalam a dan orde pertama dalam b.
 Source: nafiun.com
Source: nafiun.com
Orde reaksi ini beda dengan orde lama ataupun orde baru yang ada di mapel sejarah, ya. Perubahan laju konsentrasi setiap unsur dibagi dengan koefisiennya dalam persamaan yang seimbang. Coba kamu perhatikan rumusnya, selain ada tetapan laju reaksi, juga ada orde reaksi. Orde ini tidak bergantung pada koefisien stoikiometri reaktan, tetapi tergantung pada nilai selama eksperimen.
Orde reaksi dan persamaan laju reaksi.
M= tingkat reaksi (orde reaksi) terhadap a. Orde reaksi dan persamaan laju reaksi. Jika n=3, reaksi tersebut orde ketiga terhadap b. Menentukan orde reaksi berdasarkan analisis data yang diperoleh melalui percobaan menentukan persamaan laju. Orde reaksi (kebanyakan) bilangan bulat, tetapi juga bisa dalam bentuk pecahan dan bilangan negatif.
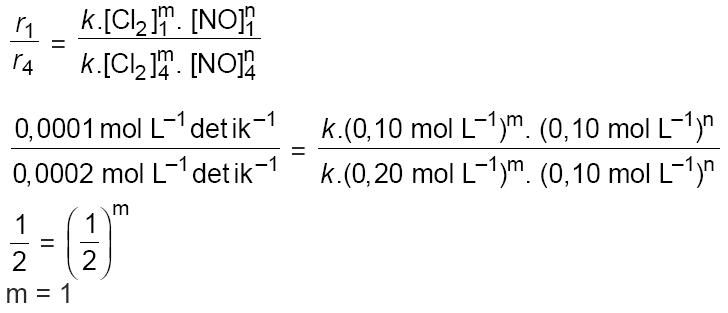 Source: nafiun.com
Source: nafiun.com
Laju reaksi adalah perbandingan perubahan konsentrasi pereaksi atau hasil reaksi terhadap perubahan waktu, yakni pada reaksi : Beberapa contoh reaksi dan rumus laju reaksi yang diperoleh dari hasil eksperimen dapat dilihat pada tabel 1. Perubahan laju konsentrasi setiap unsur dibagi dengan koefisiennya dalam persamaan yang seimbang. Menentukan orde reaksi berdasarkan analisis data yang diperoleh melalui percobaan menentukan persamaan laju. K = tetapan laju reaksi.
Orde reaksi secara keseluruhan adalah 1 + 2 = 3.
Reaksi multi langkah memiliki mekanisme reaksi, dan langkah yang paling lambat merupakan langkah penentu laju reaksi (ebbing dan gammon, 2009) 1. Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. Persamaan seperti di atas, disebut persamaan laju reaksi atau hukum laju reaksi. Lks kurikulum 2013 orde dan persamaan laju reaksi.
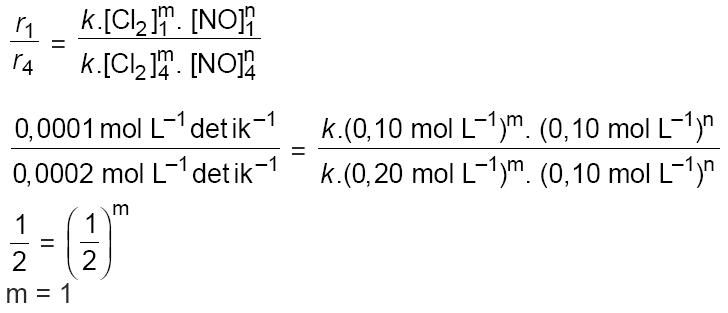 Source: nafiun.com
Source: nafiun.com
Dengan r = laju reaksi, k = tetapan laju reaksi, dan m/n = orde (tingkat) reaksi pada pereaksi a/b. Contohnya, reaksi dengan hukum laju persamaan v = k [ a ] [ b] merupakan orde pertama dalam a dan orde pertama dalam b. Persamaan laju reaksi diperoleh dari hasil percobaan/eksperiman yang secara umum memiliki persamaan r = k[a] m [b] n. Lembar kerja siswa persamaan laju dan orde reaksi hari ini kita akan mempelajari tentang persamaan laju tahukah anda dan orde reaksi, untuk itu setelah mempelajari ini kalian harus mampu:
 Source: nafiun.com
Source: nafiun.com
Contoh persamaan laju reaksi berdasarkan hasil eksperimen. A dan b adalah zat pereaksi/reaktan, sehingga [a] = konsentrasi zat a dan [b] = konsentrasi zat b. Orde reaksi ini beda dengan orde lama ataupun orde baru yang ada di mapel sejarah, ya. Lks kurikulum 2013 orde dan persamaan laju reaksi.
 Source: perpustakaancyber.blogspot.com
Source: perpustakaancyber.blogspot.com
Untuk reaksi aa + bb → cc + dd, persamaan laju reaksi ditulis: Dengan r = laju reaksi, k = tetapan laju reaksi, dan m/n = orde (tingkat) reaksi pada pereaksi a/b. Pengertian , rumus dan contoh soal laju reaksi. 17 orde reaksi (m) = 0 laju reaksi tidak tergantung pada konsentrasi reaktan:
Laju reaksi adalah perbandingan perubahan konsentrasi pereaksi atau hasil reaksi terhadap perubahan waktu, yakni pada reaksi :
M= tingkat reaksi (orde reaksi) terhadap a. Orde reaksi dan persamaan laju reaksi. Orde reaksi itu merupakan pangkat molaritas dalam persamaan laju reaksi. Orde ini tidak bergantung pada koefisien stoikiometri reaktan, tetapi tergantung pada nilai selama eksperimen. Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju.
 Source: rumuskimia.net
Source: rumuskimia.net
A dan b adalah zat pereaksi/reaktan, sehingga [a] = konsentrasi zat a dan [b] = konsentrasi zat b. Persamaan laju reaksinya dapat ditulis sebagai berikut: Dengan r = laju reaksi, k = tetapan laju reaksi, dan m/n = orde (tingkat) reaksi pada pereaksi a/b. Orde keseluruhan reaksi merupakan penjumlahan orde semua komponennya. Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi.
Orde reaksi hanya bisa ditentukan lewat percobaan.
Reaksi multi langkah memiliki mekanisme reaksi, dan langkah yang paling lambat merupakan langkah penentu laju reaksi (ebbing dan gammon, 2009) 1. Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Persamaan laju reaksi diperoleh dari hasil percobaan/eksperiman yang secara umum memiliki persamaan r = k[a] m [b] n. Orde reaksi (kebanyakan) bilangan bulat, tetapi juga bisa dalam bentuk pecahan dan bilangan negatif.
 Source: rumuskimia.net
Source: rumuskimia.net
Untuk reaksi aa + bb → cc + dd, persamaan laju reaksi ditulis: Coba kamu perhatikan rumusnya, selain ada tetapan laju reaksi, juga ada orde reaksi. Orde keseluruhan reaksi merupakan penjumlahan orde semua komponennya. K = tetapan laju reaksi. Sehingga secara keseluruhan reaksi tersebut merupakan tingkat (atau orde) ketiga.
 Source: nafiun.com
Source: nafiun.com
Jika n=3, reaksi tersebut orde ketiga terhadap b. Persamaan laju reaksi diperoleh dari hasil percobaan/eksperiman yang secara umum memiliki persamaan r = k[a] m [b] n. Orde keseluruhan reaksi merupakan penjumlahan orde semua komponennya. Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. Menentukan orde reaksi berdasarkan analisis data yang diperoleh melalui percobaan menentukan persamaan laju.
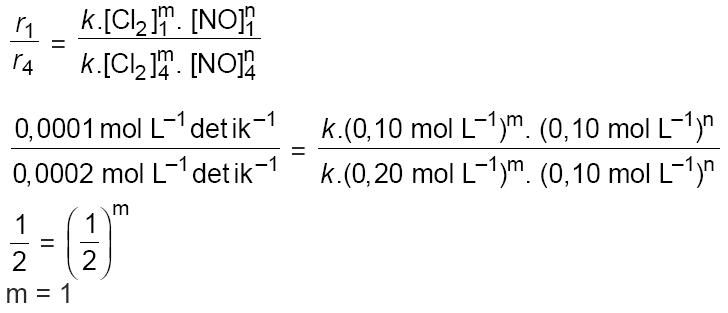 Source: nafiun.com
Source: nafiun.com
Orde ini tidak bergantung pada koefisien stoikiometri reaktan, tetapi tergantung pada nilai selama eksperimen. Dari situ dapat ditarik kesimpulan mengenai mekanisme reaksi. Orde reaksi adalah bilangan yang menyatakan besarnya pengaruh konsentrasi reaktan saat terjadi laju reaksi. Pengertian laju reaksi adalah suatu perubahan konsentrasi zat dalam suatu reaksi kimia per satuan waktu.laju reaksi ini dipengaruhi oleh beberapa faktor yaitu sifat kimia pereaksi, konsentrasi pereaksi, suhu, luas permukaan sentuh, katalis dan tekanan. Persamaan laju reaksinya adalah r = k[hgcl2]1[c2o42−]2 dalam contoh ini, orde reaksi reaktan hgcl2 adalah 1 dan orde reaksi ion oksalat adalah 2;
Situs ini adalah komunitas terbuka bagi pengguna untuk membagikan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini baik, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul pengertian laju reaksi dan orde reaksi dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.