Mengapa pada saat kesetimbangan terjadi zat zat pereaksi masih tetap ada dalam sistem jelaskan.
Jika kamu mencari artikel mengapa pada saat kesetimbangan terjadi zat zat pereaksi masih tetap ada dalam sistem jelaskan terlengkap, berarti kamu telah berada di website yang tepat. Yuk langsung aja kita simak ulasan mengapa pada saat kesetimbangan terjadi zat zat pereaksi masih tetap ada dalam sistem jelaskan berikut ini.

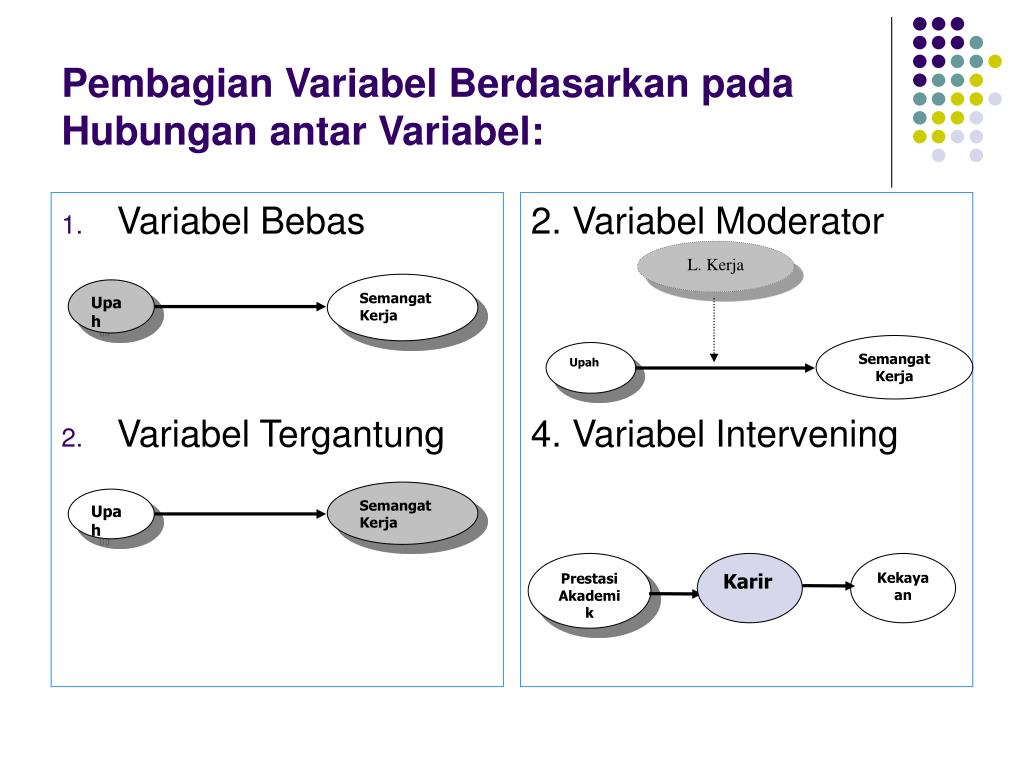
Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama.
Baca juga artikel yang mungkin berhubungan : Soal no.4 a.c karena produk dapat bereaksi kembali membentuk pereaksi. Jadi pada saat setimbang baik pereaksi maupun hasil reaksi masih tetap ada dalam sistem. Jumlah mol zat yang ada pada keadaan setimbang selalu sama. Pengambilan sampel sebanyak 5 ml dan setiap kali pengambilan dilakukan pengembalian dengan menggunakan buffer fosfat salin ph 7,4 sebanyak 5 ml.
 Source: primalangga.com
Source: primalangga.com
Konsentrasi dari setiap zat tinggal tetap pada suhu konstan. Jumlah mol zat yang ada pada keadaan setimbang selalu sama. Karena produk dapat bereaksi kembali membentuk pereaksi. Dalam keadaan setimbang dinamis laju ke produk sama dengan ke perekaksi sehingga pereaksi tidak akan habis soal no.4 View conso kesetimbangan.pdf from chem 2510 at harvard university.
Jumlah mol zat yang ada pada keadaan setimbang selalu sama.
Karena produk dapat bereaksi kembali membentuk pereaksi. Termokimia dapat didefinisikan sebagai bagian ilmu kimia yang mempelajari. Karena produk dapat bereaksi kembali membentuk pereaksi. Karena produk dapat bereaksi kembali membentuk pereaksi.

Termokimia dapat didefinisikan sebagai bagian ilmu kimia yang mempelajari. Dari opsi jawaban soal diatas, hal yang menunjukkan kesetimbangan dinamis adalah selalu ada perubahan menuju produk dan perubahan kembali. Karena produk dapat bereaksi kembali membentuk pereaksi. Kesetimbangan adalah keadaan dimana reaksi berakhir dengan suatu campuran yang mengandung baik zat pereaksi maupun hasil reaksi.hukum kesetimbangan adalah hasil kali konsentrasi setimbang zat yang berada di.
 Source: slideshare.net
Source: slideshare.net
Baca juga artikel yang mungkin berhubungan : Jumlah mol zat yang ada pada keadaan setimbang selalu sama. Jadi pada saat setimbang baik pereaksi maupun hasil reaksi masih tetap ada dalam sistem. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi.
 Source: brainly.co.id
Source: brainly.co.id
Pada saat setimbang tersebut masih ada gas n2o4, hal ini dapat dibuktikan dengan mendinginkan tabung tersebut, pada saat didinginkan warna coklat semakin pekat, ini menunjukkan bahwa gas no2 terbentuk lebih banyak. Hal ini dimaksudkan agar volume larutan tetap (tidak berkurang) dan tetap dalam keadaan sink (cs >> c). Konsentrasi produk dan reaktan tetap. Baca juga artikel yang mungkin berhubungan :
Scribd is the world's largest social reading and publishing site.
Jumlah mol zat yang ada pada keadaan setimbang selalu sama. Konsentrasi dari setiap zat tinggal tetap pada suhu konstan. Soal no.4 a.c karena produk dapat bereaksi kembali membentuk pereaksi. Pengertian, sifat, macam, rumus dan contoh soal. View conso kesetimbangan.pdf from chem 2510 at harvard university.

Karena produk dapat bereaksi kembali membentuk pereaksi. Reaksinya berlangsung dua arah pada waktu bersamaan. Karena produk dapat bereaksi kembali membentuk pereaksi. Hal ini dimaksudkan agar volume larutan tetap (tidak berkurang) dan tetap dalam keadaan sink (cs >> c). Untuk mengetahui pengaruh luas permukaan pereaksi suatu zat padat terhadap kecepatan reaksi dapat dilakukan penyelidikan berikut.
Kesetimbangan adalah prosos dinamis ketika reaksi ke depan dan reaksi balik terjadi pada laju yang sama tetapi pada arah yang berlawanan.
Menurut cato guldberg dan waage, pada suhu tetap, harga tetapan kesetimbangan akan tetap.hukum cato guldberg dan waage berbunyi: Soal no.4 a.c karena produk dapat bereaksi kembali membentuk pereaksi. View conso kesetimbangan.pdf from chem 2510 at harvard university. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama.
 Source: seputarilmu.com
Source: seputarilmu.com
Scribd is the world's largest social reading and publishing site. Terjadi dalam wadah tertutup, pada suhu dan tekanan tetap. Kesetimbangan adalah prosos dinamis ketika reaksi ke depan dan reaksi balik terjadi pada laju yang sama tetapi pada arah yang berlawanan. Termokimia merupakan penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia.
 Source: slideshare.net
Source: slideshare.net
Menurut cato guldberg dan waage, pada suhu tetap, harga tetapan kesetimbangan akan tetap.hukum cato guldberg dan waage berbunyi: Dalam keadaan setimbang dinamis laju ke produk sama dengan ke perekaksi sehingga pereaksi tidak akan habis Baca juga artikel yang mungkin berhubungan : Terjadi dalam wadah tertutup, pada suhu dan tekanan tetap.
 Source: slideshare.net
Source: slideshare.net
Karena produk dapat bereaksi kembali membentuk pereaksi. Karena produk dapat bereaksi kembali membentuk pereaksi. Konsentrasi dari setiap zat tinggal tetap pada suhu konstan. Karena produk dapat bereaksi kembali membentuk pereaksi.
Scribd is the world's largest social reading and publishing site.
Karena produk dapat bereaksi kembali membentuk pereaksi. Dalam keadaan setimbang dinamis laju ke produk sama dengan ke perekaksi sehingga pereaksi tidak akan habis soal no.4 Kesetimbangan adalah prosos dinamis ketika reaksi ke depan dan reaksi balik terjadi pada laju yang sama tetapi pada arah yang berlawanan. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi. Reaksinya berlangsung dua arah pada waktu bersamaan.
 Source: seputarilmu.com
Source: seputarilmu.com
Jumlah mol zat yang ada pada keadaan setimbang selalu sama. Reaksinya berlangsung dua arah pada waktu bersamaan. Kesetimbangan adalah keadaan dimana reaksi berakhir dengan suatu campuran yang mengandung baik zat pereaksi maupun hasil reaksi.hukum kesetimbangan adalah hasil kali konsentrasi setimbang zat yang berada di. Terjadi dalam wadah tertutup, pada suhu dan tekanan tetap. Dalam keadaan setimbang dinamis laju ke produk sama dengan ke perekaksi sehingga pereaksi tidak akan habis soal no.4
Jadi pada saat setimbang baik pereaksi maupun hasil reaksi masih tetap ada dalam sistem.
Jadi pada saat setimbang baik pereaksi maupun hasil reaksi masih tetap ada dalam sistem. Pada kesetimbangan homogen semua zat yang ada dalam sistem kesetimbangan memiliki fase yang sama ada dalam bentuk gas dan larutan. Contoh soal & pembahasan reaksi kesetimbangan tan soal no.1 reaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang Hal ini dimaksudkan agar volume larutan tetap (tidak berkurang) dan tetap dalam keadaan sink (cs >> c).
 Source: slideshare.net
Source: slideshare.net
Reaksi akan terjadi terus menerus secara mikroskopis sehingga disebut kesetimbangan dinamis. Termokimia dapat didefinisikan sebagai bagian ilmu kimia yang mempelajari. Dari opsi jawaban soal diatas, hal yang menunjukkan kesetimbangan dinamis adalah selalu ada perubahan menuju produk dan perubahan kembali. Soal no.4 a.c karena produk dapat bereaksi kembali membentuk pereaksi.
 Source: seputarilmu.com
Source: seputarilmu.com
Menurut cato guldberg dan waage, pada suhu tetap, harga tetapan kesetimbangan akan tetap.hukum cato guldberg dan waage berbunyi: Konsentrasi produk dan reaktan tetap. Kesetimbangan kimia tujuan pembelajaran setelah mengikuti pembelajaran siswa dapat : Menurut cato guldberg dan waage, pada suhu tetap, harga tetapan kesetimbangan akan tetap.hukum cato guldberg dan waage berbunyi:
 Source: academia.edu
Source: academia.edu
Karena produk dapat bereaksi kembali membentuk pereaksi. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi. View conso kesetimbangan.pdf from chem 2510 at harvard university. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama.
Terjadi dalam wadah tertutup, pada suhu dan tekanan tetap.
Dalam keadaan setimbang dinamis laju ke produk sama dengan ke perekaksi sehingga pereaksi tidak akan habis Karena produk dapat bereaksi kembali membentuk pereaksi. Pada saat setimbang tersebut masih ada gas n2o4, hal ini dapat dibuktikan dengan mendinginkan tabung tersebut, pada saat didinginkan warna coklat semakin pekat, ini menunjukkan bahwa gas no2 terbentuk lebih banyak. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama. Kesetimbangan adalah keadaan dimana reaksi berakhir dengan suatu campuran yang mengandung baik zat pereaksi maupun hasil reaksi.hukum kesetimbangan adalah hasil kali konsentrasi setimbang zat yang berada di.
 Source: seputarilmu.com
Source: seputarilmu.com
Jumlah mol zat yang ada pada keadaan setimbang selalu sama. Karena produk dapat bereaksi kembali membentuk pereaksi. Menurut cato guldberg dan waage, pada suhu tetap, harga tetapan kesetimbangan akan tetap.hukum cato guldberg dan waage berbunyi: Jadi pada saat setimbang baik pereaksi maupun hasil reaksi masih tetap ada dalam sistem. Untuk mengetahui pengaruh luas permukaan pereaksi suatu zat padat terhadap kecepatan reaksi dapat dilakukan penyelidikan berikut.
Pada saat setimbang tersebut masih ada gas n2o4, hal ini dapat dibuktikan dengan mendinginkan tabung tersebut, pada saat didinginkan warna coklat semakin pekat, ini menunjukkan bahwa gas no2 terbentuk lebih banyak.
Kesetimbangan adalah prosos dinamis ketika reaksi ke depan dan reaksi balik terjadi pada laju yang sama tetapi pada arah yang berlawanan. Dalam keadaan setimbang dinamis laju ke produk sama dengan ke perekaksi sehingga pereaksi tidak akan habis soal no.4 Dari opsi jawaban soal diatas, hal yang menunjukkan kesetimbangan dinamis adalah selalu ada perubahan menuju produk dan perubahan kembali. Pada praktikum kali ini, percobaan dilakukan dengan asumsi:
 Source: slideshare.net
Source: slideshare.net
Konsentrasi produk dan reaktan tetap. Kesetimbangan adalah prosos dinamis ketika reaksi ke depan dan reaksi balik terjadi pada laju yang sama tetapi pada arah yang berlawanan. Baca juga artikel yang mungkin berhubungan : Termokimia merupakan penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia. Dari opsi jawaban soal diatas, hal yang menunjukkan kesetimbangan dinamis adalah selalu ada perubahan menuju produk dan perubahan kembali.
 Source: slideshare.net
Source: slideshare.net
Kesetimbangan kimia tujuan pembelajaran setelah mengikuti pembelajaran siswa dapat : Jumlah mol zat yang ada pada keadaan setimbang selalu sama. Termokimia dapat didefinisikan sebagai bagian ilmu kimia yang mempelajari. Menentukan harga konstanta kesetimbangan, kc dan kp, 4. Pengambilan sampel sebanyak 5 ml dan setiap kali pengambilan dilakukan pengembalian dengan menggunakan buffer fosfat salin ph 7,4 sebanyak 5 ml.
 Source: brainly.co.id
Source: brainly.co.id
Konsentrasi produk dan reaktan tetap. Baca juga artikel yang mungkin berhubungan : Menurut cato guldberg dan waage, pada suhu tetap, harga tetapan kesetimbangan akan tetap.hukum cato guldberg dan waage berbunyi: Untuk mengetahui pengaruh luas permukaan pereaksi suatu zat padat terhadap kecepatan reaksi dapat dilakukan penyelidikan berikut. Pengambilan sampel sebanyak 5 ml dan setiap kali pengambilan dilakukan pengembalian dengan menggunakan buffer fosfat salin ph 7,4 sebanyak 5 ml.
Situs ini adalah komunitas terbuka bagi pengguna untuk membagikan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini lengkap, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul mengapa pada saat kesetimbangan terjadi zat zat pereaksi masih tetap ada dalam sistem jelaskan dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.