Jenis ikatan kovalen berdasarkan jumlah pei nya ikatan kovalen.
Jika kamu sedang mencari artikel jenis ikatan kovalen berdasarkan jumlah pei nya ikatan kovalen terlengkap, berarti kamu telah berada di web yang benar. Yuk langsung aja kita simak pembahasan jenis ikatan kovalen berdasarkan jumlah pei nya ikatan kovalen berikut ini.
 Ikatan Kovalen Tunggal Definisi Proses Pembentukan Contoh Soal Dan Pembahasan Blog Kimia From blogmipa-kimia.blogspot.com
Ikatan Kovalen Tunggal Definisi Proses Pembentukan Contoh Soal Dan Pembahasan Blog Kimia From blogmipa-kimia.blogspot.com
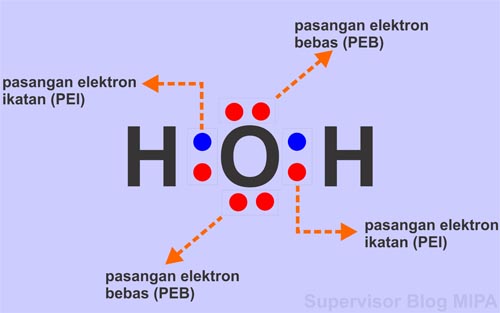
Pasangan elektron yang digunakan bersama oleh dua atom yang diberikan disebut dengan pasangan elektron ikatan (pei), sedangkan pasangan elektron yang tidak digunakan bersama oleh kedua atom disebut.
Jika sobat lihat konfigurasi elektron dari atom sulfur (belerang) [2, 8, 6] ia memiliki 6 elektron dan hanya membutuhkan tambahan 2 elektron. Simbol yang digunakan untuk jenis kovalen rangkap dua ini adalah garis dua (=). Otomatis hanya ada 1 ikatan kovalen biasa dan selebihnya hanya ikatan kovalen koordinasi. H 2 o, co 2. Pasangan elektron yang digunakan bersama oleh dua atom yang diberikan disebut dengan pasangan elektron ikatan (pei), sedangkan pasangan elektron yang tidak digunakan bersama oleh kedua atom disebut.
 Source: blogmipa-kimia.blogspot.com
Source: blogmipa-kimia.blogspot.com
Pengertian ikatan kovalen dan proses terbentuknya 4. H 2, h 2 o (konfigurasi elektron h = 1; H 2 o, co 2. Ikatan kovalen pada molekul sulfur trioksida (so 3). Simbol yang digunakan untuk jenis kovalen rangkap dua ini adalah garis dua (=).
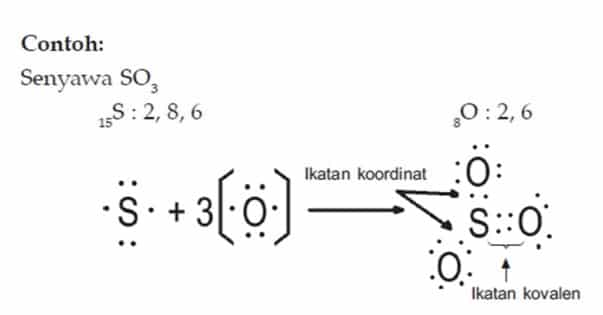
Ikatan kovalen pada molekul sulfur trioksida (so 3).
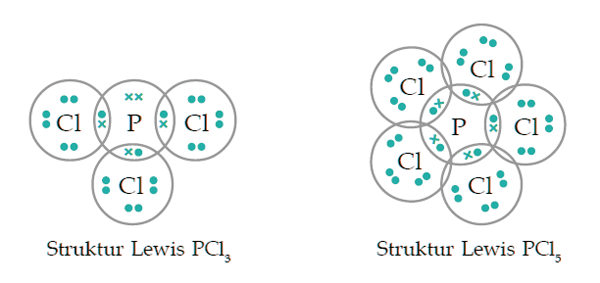
Berdasarkan jumlah pei yang terdapat pada suatu molekul, ikatan kovalen dibedakan menjadi tiga yang meliputi ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga. Pasangan elektron yang digunakan bersama oleh dua atom yang diberikan disebut dengan pasangan elektron ikatan (pei), sedangkan pasangan elektron yang tidak digunakan bersama oleh kedua atom disebut. O = 2, 6) ikatan kovalen rangkap dua. Ikatan yang terjadi ini dapat berupa ikatan kovalen biasa atau ikatan kovalen koordinasi.

H 2, h 2 o (konfigurasi elektron h = 1; O = 2, 6) ikatan kovalen rangkap dua. H 2 , n 2 , o 2 , dan berbeda jenis contoh: Pada h 2 o, jumlah ikatan kovalen = 4 elektron :
 Source: seputarilmu.com
Source: seputarilmu.com
Ikatan kovalen polar dan nonpolar 7. Ikatan kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Otomatis hanya ada 1 ikatan kovalen biasa dan selebihnya hanya ikatan kovalen koordinasi. Ikatan kovalen berdasarkan jumlah pei.
 Source: siswapedia.com
Source: siswapedia.com
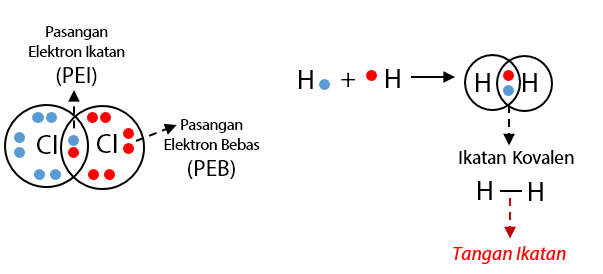
Pasangan elektron yang dipakai bersama disebut pasangan elektron ikatan (pei) dan pasangan elektron valensi yang tidak terlibat dalam pembentukan ikatan kovalen disebut pasangan elektron bebas (peb). 2 = 2 ikatan kovalen. Ikatan kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Dalam pembentukan ikatan kovalen, belum tentu semua elektron valensi digunakan untuk membentuk pasangan elektron bersama.
Jenis ikatan ini memiliki dua pasang atau 4 buah elektron pei (pasangan elektron ikatan) sama seperti namanya.
Bentuk geometri molekul soal 1 Berdasarkan jumlah pei yang terdapat pada suatu molekul, ikatan kovalen dibedakan menjadi tiga yang meliputi ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga. Jenis ikatan ini memiliki dua pasang atau 4 buah elektron pei (pasangan elektron ikatan) sama seperti namanya. Jumlah pei pada suatu molekul berpengaruh pada kuat atau lemahnya ikatan yang terdapat pada molekul tersebut. Ikatan kovalen pada molekul sulfur trioksida (so 3).

Jika terdapat muatan plus (+) kurangkan elektron sebanyak muatan plusnya itu. Berdasarkan jumlah pei yang terdapat pada suatu molekul, ikatan kovalen dibedakan menjadi tiga yang meliputi ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga. Konfigurasi elektron berdasarkan kaidah oktet dan duplet Otomatis hanya ada 1 ikatan kovalen biasa dan selebihnya hanya ikatan kovalen koordinasi. 2 = 2 ikatan kovalen.
Simbol yang digunakan untuk jenis kovalen rangkap dua ini adalah garis dua (=).
Pada h 2 o, jumlah ikatan kovalen = 4 elektron : H 2, h 2 o (konfigurasi elektron h = 1; Jumlah pei pada suatu molekul berpengaruh pada kuat atau lemahnya ikatan yang terdapat pada molekul tersebut. Pasangan elektron yang digunakan bersama oleh dua atom yang diberikan disebut dengan pasangan elektron ikatan (pei), sedangkan pasangan elektron yang tidak digunakan bersama oleh kedua atom disebut.
 Source: seputarilmu.com
Source: seputarilmu.com
Dalam pembentukan ikatan kovalen, belum tentu semua elektron valensi digunakan untuk membentuk pasangan elektron bersama. Dalam kimia, ikatan kovalen dikelompokkan berdasarkan karakteristik tertentu. H 2, h 2 o (konfigurasi elektron h = 1; Jika terdapat muatan plus (+) kurangkan elektron sebanyak muatan plusnya itu.
 Source: dosenpendidikan.co.id
Source: dosenpendidikan.co.id
Ikatan kovalen pada molekul sulfur trioksida (so 3). Jika terdapat muatan plus (+) kurangkan elektron sebanyak muatan plusnya itu. H 2, h 2 o (konfigurasi elektron h = 1; Tapi dalam senyawa so 3 ada 3 ikatan kovalen rangkap.
 Source: gurupendidikan.co.id
Source: gurupendidikan.co.id
Ikatan kovalen berdasarkan jumlah pei. Ikatan kovalen tunggal, adalah ikatan yang terbentuk dari penggunaan. O = 2, 6) ikatan kovalen rangkap dua. Jumlah pei pada suatu molekul berpengaruh pada kuat atau lemahnya ikatan yang terdapat pada molekul tersebut.
Ikatan kovalen polar dan nonpolar 7.
Dalam kimia, ikatan kovalen dikelompokkan berdasarkan karakteristik tertentu. Jika terdapat muatan plus (+) kurangkan elektron sebanyak muatan plusnya itu. 2 = 2 ikatan kovalen. Berdasarkan jumlah pei yang terdapat pada suatu molekul, ikatan kovalen dibedakan menjadi tiga yang meliputi ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga. Otomatis hanya ada 1 ikatan kovalen biasa dan selebihnya hanya ikatan kovalen koordinasi.
 Source: dosenpendidikan.co.id
Source: dosenpendidikan.co.id
Berdasarkan jumlah pei yang terdapat pada suatu molekul, ikatan kovalen dibedakan menjadi tiga yang meliputi ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga. O = 2, 6) ikatan kovalen rangkap dua. H 2 , n 2 , o 2 , dan berbeda jenis contoh: Tapi dalam senyawa so 3 ada 3 ikatan kovalen rangkap. Simbol yang digunakan untuk jenis kovalen rangkap dua ini adalah garis dua (=).
H 2 o, co 2.
Jika sobat lihat konfigurasi elektron dari atom sulfur (belerang) [2, 8, 6] ia memiliki 6 elektron dan hanya membutuhkan tambahan 2 elektron. H 2, h 2 o (konfigurasi elektron h = 1; Jika sobat lihat konfigurasi elektron dari atom sulfur (belerang) [2, 8, 6] ia memiliki 6 elektron dan hanya membutuhkan tambahan 2 elektron. Penulisan rumus lewis dari suatu senyawa kovalen 5.

Simbol yang digunakan untuk jenis kovalen rangkap dua ini adalah garis dua (=). Penulisan rumus lewis dari suatu senyawa kovalen 5. Ikatan kovalen tunggal yaitu ikatan kovalen yang memiliki 1 pasang pei. Tapi dalam senyawa so 3 ada 3 ikatan kovalen rangkap.
 Source: idschool.net
Source: idschool.net
Ikatan kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Dalam pembentukan ikatan kovalen, belum tentu semua elektron valensi digunakan untuk membentuk pasangan elektron bersama. Pasangan elektron yang digunakan bersama oleh dua atom yang diberikan disebut dengan pasangan elektron ikatan (pei), sedangkan pasangan elektron yang tidak digunakan bersama oleh kedua atom disebut. Jika terdapat muatan plus (+) kurangkan elektron sebanyak muatan plusnya itu.
 Source: idschool.net
Source: idschool.net
H 2, h 2 o (konfigurasi elektron h = 1; Jika sobat lihat konfigurasi elektron dari atom sulfur (belerang) [2, 8, 6] ia memiliki 6 elektron dan hanya membutuhkan tambahan 2 elektron. Jumlah pei pada suatu molekul berpengaruh pada kuat atau lemahnya ikatan yang terdapat pada molekul tersebut. H 2 o, co 2.
Berdasarkan jumlah pei yang terdapat pada suatu molekul, ikatan kovalen dibedakan menjadi tiga yang meliputi ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga.
H 2, h 2 o (konfigurasi elektron h = 1; Pengertian ikatan ion dan proses terbentunya 3. Ikatan kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Dalam kimia, ikatan kovalen dikelompokkan berdasarkan karakteristik tertentu. Ikatan kovalen tunggal yaitu ikatan kovalen yang memiliki 1 pasang pei.
 Source: dosenpendidikan.co.id
Source: dosenpendidikan.co.id
Otomatis hanya ada 1 ikatan kovalen biasa dan selebihnya hanya ikatan kovalen koordinasi. Otomatis hanya ada 1 ikatan kovalen biasa dan selebihnya hanya ikatan kovalen koordinasi. H 2, h 2 o (konfigurasi elektron h = 1; H 2, h 2 o (konfigurasi elektron h = 1; Dalam kimia, ikatan kovalen dikelompokkan berdasarkan karakteristik tertentu.
H 2, h 2 o (konfigurasi elektron h = 1;
H 2 , n 2 , o 2 , dan berbeda jenis contoh: Jenis ikatan ini memiliki dua pasang atau 4 buah elektron pei (pasangan elektron ikatan) sama seperti namanya. Ikatan kovalen pada molekul sulfur trioksida (so 3). Pengertian ikatan ion dan proses terbentunya 3.
 Source: idschool.net
Source: idschool.net
Pasangan elektron yang dipakai bersama disebut pasangan elektron ikatan (pei) dan pasangan elektron valensi yang tidak terlibat dalam pembentukan ikatan kovalen disebut pasangan elektron bebas (peb). Pengertian ikatan kovalen dan proses terbentuknya 4. Jumlah pei pada suatu molekul berpengaruh pada kuat atau lemahnya ikatan yang terdapat pada molekul tersebut. Dalam kimia, ikatan kovalen dikelompokkan berdasarkan karakteristik tertentu. Pasangan elektron yang digunakan bersama oleh dua atom yang diberikan disebut dengan pasangan elektron ikatan (pei), sedangkan pasangan elektron yang tidak digunakan bersama oleh kedua atom disebut.
 Source: seputarilmu.com
Source: seputarilmu.com
Jenis ikatan ini memiliki dua pasang atau 4 buah elektron pei (pasangan elektron ikatan) sama seperti namanya. 2 atom terikat oleh ikatan tunggal yang berasal dari 1 pasang elektron. Berdasarkan jumlah pei yang terdapat pada suatu molekul, ikatan kovalen dibedakan menjadi tiga yang meliputi ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga. H 2, h 2 o (konfigurasi elektron h = 1; Tapi dalam senyawa so 3 ada 3 ikatan kovalen rangkap.
 Source: gurupendidikan.co.id
Source: gurupendidikan.co.id
Bentuk geometri molekul soal 1 Konfigurasi elektron berdasarkan kaidah oktet dan duplet Otomatis hanya ada 1 ikatan kovalen biasa dan selebihnya hanya ikatan kovalen koordinasi. H 2 o, co 2. 2 = 2 ikatan kovalen.
Situs ini adalah komunitas terbuka bagi pengguna untuk membagikan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini lengkap, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga save halaman blog ini dengan judul jenis ikatan kovalen berdasarkan jumlah pei nya ikatan kovalen dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.





