Hukum 1 termodinamika dan kapasitas kalor gas.
Jika kamu sedang mencari artikel hukum 1 termodinamika dan kapasitas kalor gas terlengkap, berarti kamu sudah berada di website yang tepat. Yuk langsung aja kita simak penjelasan hukum 1 termodinamika dan kapasitas kalor gas berikut ini.
 Hukum dan Sifat Sifat Gas Bisakimia From bisakimia.com
Hukum dan Sifat Sifat Gas Bisakimia From bisakimia.com
Kapasitas kalor hukum i termodinamika.
“hukum 1 termodinamika” 11) suatu gas menerima kalor 1.500 kalori, menghasilkan usaha sebesar 4.000 j. Efisiensi mesin otto memenuhi persamaan bab 12 gas dan termodinamika 1007 1 1 1 r 12.59 dengan r = v 2 v 1 adalah rasio volume ruang silinder saat piston dalam posisi terjauh dan tedekat dari dinding silinder = c p c v adalah koefisien adiabatik gambar 12.27 siklus otto yang dibentuk oleh dua buak proses adiabatik ab dan cd dan dua buah proses. Secara matematis dapat dinyatakan dengan persamaan berikut : Kalor yang diserap (j) c : Termodinamika, (4) sistem dan persamaan keadaan sistem, (5) usaha luar, (6) kalor dan hukum i termodinamika, (7) hukum ii termodinamika, (8) siklus carnot dan entropi, (9).
 Source: slideserve.com
Source: slideserve.com
Perubahan keadaan sistem akibat adanya perpindahan energi antara sistem dan lingkungan yang melibatkan kalor dan kerja, disebut sebagai proses termodinamika. Hukum pertama termodinamika merupakan salah satu contoh hukum kekekalan energi. Kapasitas kalor gas sangat dipengaruhi oleh tekanan, namun pengaruh tekanan pada sifat termodinamika tidak digunakan dalam. Hukum kedua termodinamika dan aplikasinya a. “hukum 1 termodinamika” 11) suatu gas menerima kalor 1.500 kalori, menghasilkan usaha sebesar 4.000 j.
Perumusan kedua pada kapasitas kalor tersebut secara matematis dapat dituliskan sebagai berikut.
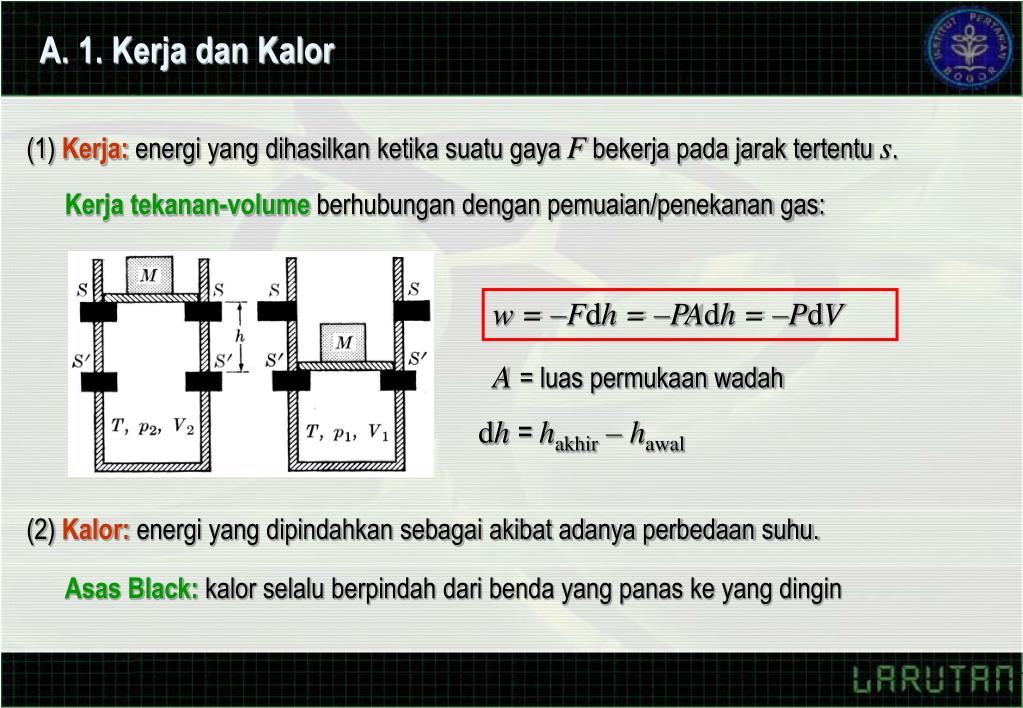
Hukum termodinamika 1 jika suatu sistem memperoleh energi dalam bentuk kalor (q) dan pada saat yang sama kehilangan energi yang diubah dalam bentuk usaha (w), maka perubahan energi dalam sistem (δu) tersebut adalah sama dengan besarnya selisih kalor dan usaha. Q = kalor yang diserap (j) c = kapasitas kalor (j/k) δt = perubahan suhu (k) persamaan ini berlaku untuk gas. Q = w + δu atau. Jadi, perubahan energi dalam system adalah 2010,4 j.
 Source: bisakimia.com
Source: bisakimia.com
“hukum 1 termodinamika” 11) suatu gas menerima kalor 1.500 kalori, menghasilkan usaha sebesar 4.000 j. Kapasitas kalor (j/k) t : Satuan kalor adalah kalori (disingkat kal). Rumus mencari perubahan energi dalam sistem gas hukum termodinamika, besarnya perubahan energi internal atau dalam system yang menyerap kalor dan melakukan usaha kerja dapat dinyatakan dengan persamaan rumus berikut:
 Source: slideshare.net
Source: slideshare.net
Perubahan usaha menjadi kalor dan sebaliknya. Q = w + δu atau. Q = kalor yang diserap (j) c = kapasitas kalor (j/k) δt = perubahan suhu (k) persamaan ini berlaku untuk gas. Karena yang konstan adalah tekanan, maka perubahan energi dalam, kalor, dan kerja pada proses ini tidak ada yang bernilai nol.
 Source: slideserve.com
Source: slideserve.com
Q = kalor yang diserap (j) c = kapasitas kalor (j/k) δt = perubahan suhu (k) persamaan ini berlaku untuk gas. 1306399071 (24) teknik metalurgi dan material fakultas teknik universitas indonesia 2014 f kata pengantar puji syukur penulis penjatkan kehadirat. Untuk jumlah kalor yang sama, kenaikan suhu air sebesar 1 oc hanya terjadi antara suhu 14,5 oc sampai. Hukum pertama termodinamika merupakan salah satu contoh hukum kekekalan energi.
1306399071 (24) teknik metalurgi dan material fakultas teknik universitas indonesia 2014 f kata pengantar puji syukur penulis penjatkan kehadirat.
Fisika kelas xi 276 c = q ∆ t keterangan: Perubahan usaha menjadi kalor dan sebaliknya. Kalori adalah jumlah kalor yang diperlukan untuk menaikan suhu 1 gram air sebesar 1 co (tepatnya dari 14,5 oc menjadi 15,5 oc). Untuk mengetahui hukum nol , dimisalkan ada gas seperti pada gambar di bawah. Efisiensi mesin otto memenuhi persamaan bab 12 gas dan termodinamika 1007 1 1 1 r 12.59 dengan r = v 2 v 1 adalah rasio volume ruang silinder saat piston dalam posisi terjauh dan tedekat dari dinding silinder = c p c v adalah koefisien adiabatik gambar 12.27 siklus otto yang dibentuk oleh dua buak proses adiabatik ab dan cd dan dua buah proses.
 Source: slideshare.net
Source: slideshare.net
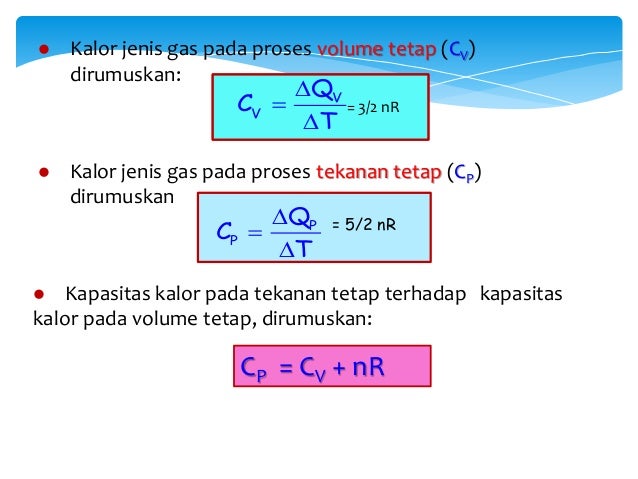
Untuk jumlah kalor yang sama, kenaikan suhu air sebesar 1 oc hanya terjadi antara suhu 14,5 oc sampai. Kapasitas kalor gas pada tekanan tetap (cp) kapasitas kalor gas adalah kalor yang diperlukan untuk menaikan suhu suatu zat satu kelvin pada tekanan tetap. Kalori adalah jumlah kalor yang diperlukan untuk menaikan suhu 1 gram air sebesar 1 co (tepatnya dari 14,5 oc menjadi 15,5 oc). Cp cv usaha yang dilakukan oleh sistem (gas) hanya mengubah energi dalam, sebab sistem tidak menerima ataupun melepas kalor. Q = kalor yang diserap (j) c = kapasitas kalor (j/k) δt = perubahan suhu (k) persamaan ini berlaku untuk gas.
1306399071 (24) teknik metalurgi dan material fakultas teknik universitas indonesia 2014 f kata pengantar puji syukur penulis penjatkan kehadirat.
Perubahan usaha menjadi kalor dan sebaliknya. Kapasitas kalor gas pada tekanan tetap (cp) kapasitas kalor gas adalah kalor yang diperlukan untuk menaikan suhu suatu zat satu kelvin pada tekanan tetap. Untuk mengetahui hukum nol , dimisalkan ada gas seperti pada gambar di bawah. Pada materi 1 ini kamu akan mempelajari hukum i termodinamika, perhatikan gambar berikut ini!
 Source: slideserve.com
Source: slideserve.com
Secara matematis dapat dinyatakan dengan persamaan berikut : Kapasitas kalor gas pada tekanan tetap (c p) Hukum pertama termodinamika merupakan salah satu contoh hukum kekekalan energi. Kapasitas kalor (j/k) t :
 Source: slideserve.com
Source: slideserve.com
Perubahan usaha menjadi kalor dan sebaliknya. Perubahan keadaan sistem akibat adanya perpindahan energi antara sistem dan lingkungan yang melibatkan kalor dan kerja, disebut sebagai proses termodinamika. Kalori adalah jumlah kalor yang diperlukan untuk menaikan suhu 1 gram air sebesar 1 co (tepatnya dari 14,5 oc menjadi 15,5 oc). Kapasitas kalor gas pada tekanan tetap besarnya dapat diturunkan dari pada proses isobarik.
 Source: slideserve.com
Source: slideserve.com
Satuan kalor adalah kalori (disingkat kal). Fisika kelas xi 276 c = q ∆ t keterangan: Efisiensi mesin otto memenuhi persamaan bab 12 gas dan termodinamika 1007 1 1 1 r 12.59 dengan r = v 2 v 1 adalah rasio volume ruang silinder saat piston dalam posisi terjauh dan tedekat dari dinding silinder = c p c v adalah koefisien adiabatik gambar 12.27 siklus otto yang dibentuk oleh dua buak proses adiabatik ab dan cd dan dua buah proses. Cp cv usaha yang dilakukan oleh sistem (gas) hanya mengubah energi dalam, sebab sistem tidak menerima ataupun melepas kalor.
Efisiensi mesin otto memenuhi persamaan bab 12 gas dan termodinamika 1007 1 1 1 r 12.59 dengan r = v 2 v 1 adalah rasio volume ruang silinder saat piston dalam posisi terjauh dan tedekat dari dinding silinder = c p c v adalah koefisien adiabatik gambar 12.27 siklus otto yang dibentuk oleh dua buak proses adiabatik ab dan cd dan dua buah proses.
Kapasitas kalor gas sangat dipengaruhi oleh tekanan, namun pengaruh tekanan pada sifat termodinamika tidak digunakan dalam. Kalor yang diserap (j) c : Jadi, perubahan energi dalam system adalah 2010,4 j. Efisiensi mesin otto memenuhi persamaan bab 12 gas dan termodinamika 1007 1 1 1 r 12.59 dengan r = v 2 v 1 adalah rasio volume ruang silinder saat piston dalam posisi terjauh dan tedekat dari dinding silinder = c p c v adalah koefisien adiabatik gambar 12.27 siklus otto yang dibentuk oleh dua buak proses adiabatik ab dan cd dan dua buah proses. “hukum 1 termodinamika” 11) suatu gas menerima kalor 1.500 kalori, menghasilkan usaha sebesar 4.000 j.
 Source: bisakimia.com
Source: bisakimia.com
Q = kalor yang diserap (j) c = kapasitas kalor (j/k) δt = perubahan suhu (k) persamaan ini berlaku untuk gas. Pada materi 1 ini kamu akan mempelajari hukum i termodinamika, perhatikan gambar berikut ini! Rumus mencari perubahan energi dalam sistem gas hukum termodinamika, besarnya perubahan energi internal atau dalam system yang menyerap kalor dan melakukan usaha kerja dapat dinyatakan dengan persamaan rumus berikut: Kapasitas kalor gas pada tekanan tetap besarnya dapat diturunkan dari pada proses isobarik. Makalah hukum 1 termodinamika termodinamika material 02 reguler kelompok 12 disusun oleh :
Pada materi 1 ini kamu akan mempelajari hukum i termodinamika, perhatikan gambar berikut ini!
Secara matematis dapat dinyatakan dengan persamaan berikut : Kapasitas kalor gas sangat dipengaruhi oleh tekanan, namun pengaruh tekanan pada sifat termodinamika tidak digunakan dalam. Q = w + δu atau. Kapasitas kalor adalah banyaknya kalor yang diperlukan untuk menaikkan suhu sebesar 1 kelvin.
 Source: slideserve.com
Source: slideserve.com
Termodinamika, (4) sistem dan persamaan keadaan sistem, (5) usaha luar, (6) kalor dan hukum i termodinamika, (7) hukum ii termodinamika, (8) siklus carnot dan entropi, (9). Termodinamika, (4) sistem dan persamaan keadaan sistem, (5) usaha luar, (6) kalor dan hukum i termodinamika, (7) hukum ii termodinamika, (8) siklus carnot dan entropi, (9). Satuan kalor adalah kalori (disingkat kal). Untuk mengetahui hukum nol , dimisalkan ada gas seperti pada gambar di bawah.
 Source: slideshare.net
Source: slideshare.net
Kapasitas kalor gas sangat dipengaruhi oleh tekanan, namun pengaruh tekanan pada sifat termodinamika tidak digunakan dalam. Kapasitas kalor gas sangat dipengaruhi oleh tekanan, namun pengaruh tekanan pada sifat termodinamika tidak digunakan dalam. Pada materi 1 ini kamu akan mempelajari hukum i termodinamika, perhatikan gambar berikut ini! Artinya, untuk menaikkan suhu pada volume sedikit lebih mudah daripada.
 Source: fisika1988.blogspot.com
Source: fisika1988.blogspot.com
“hukum 1 termodinamika” 11) suatu gas menerima kalor 1.500 kalori, menghasilkan usaha sebesar 4.000 j. Kapasitas kalor (j/k) t : Pada materi 1 ini kamu akan mempelajari hukum i termodinamika, perhatikan gambar berikut ini! Termodinamika, (4) sistem dan persamaan keadaan sistem, (5) usaha luar, (6) kalor dan hukum i termodinamika, (7) hukum ii termodinamika, (8) siklus carnot dan entropi, (9).
“hukum 1 termodinamika” 11) suatu gas menerima kalor 1.500 kalori, menghasilkan usaha sebesar 4.000 j.
Kapasitas kalor (j/k) t : Perubahan usaha menjadi kalor dan sebaliknya. Untuk jumlah kalor yang sama, kenaikan suhu air sebesar 1 oc hanya terjadi antara suhu 14,5 oc sampai. Kapasitas kalor gas pada tekanan tetap (cp) kapasitas kalor gas adalah kalor yang diperlukan untuk menaikan suhu suatu zat satu kelvin pada tekanan tetap. Kalor yang diserap (j) c :
 Source: slideserve.com
Source: slideserve.com
Perubahan usaha menjadi kalor dan sebaliknya. Kapasitas kalor gas sangat dipengaruhi oleh tekanan, namun pengaruh tekanan pada sifat termodinamika tidak digunakan dalam. Kapasitas kalor (j/k) t : Fisika kelas xi 276 c = q ∆ t keterangan: Karena gas pada tekanan rendah biasanya mendekati ideal, kapasitas kalor gas ideal bisa digunakan untuk hampir semua perhitungan gas real pada tekanan atmosfir.
Termodinamika, (4) sistem dan persamaan keadaan sistem, (5) usaha luar, (6) kalor dan hukum i termodinamika, (7) hukum ii termodinamika, (8) siklus carnot dan entropi, (9).
Hukum termodinamika 1 jika suatu sistem memperoleh energi dalam bentuk kalor (q) dan pada saat yang sama kehilangan energi yang diubah dalam bentuk usaha (w), maka perubahan energi dalam sistem (δu) tersebut adalah sama dengan besarnya selisih kalor dan usaha. “hukum 1 termodinamika” 11) suatu gas menerima kalor 1.500 kalori, menghasilkan usaha sebesar 4.000 j. Perubahan suhu (k) ada dua macam kapasitas kalor pada gas, yaitu kapasitas kalor pada tekanan tetap (cp) dan kapasitas kalor pada volume tetap (cv ). Tekanan system dijaga selalu konstan.
 Source: fisika1988.blogspot.com
Source: fisika1988.blogspot.com
Tekanan system dijaga selalu konstan. Makalah hukum 1 termodinamika termodinamika material 02 reguler kelompok 12 disusun oleh : Hukum termodinamika 1 jika suatu sistem memperoleh energi dalam bentuk kalor (q) dan pada saat yang sama kehilangan energi yang diubah dalam bentuk usaha (w), maka perubahan energi dalam sistem (δu) tersebut adalah sama dengan besarnya selisih kalor dan usaha. Untuk mengetahui hukum nol , dimisalkan ada gas seperti pada gambar di bawah. Termodinamika, (4) sistem dan persamaan keadaan sistem, (5) usaha luar, (6) kalor dan hukum i termodinamika, (7) hukum ii termodinamika, (8) siklus carnot dan entropi, (9).
 Source: slideserve.com
Source: slideserve.com
Untuk mengetahui hukum nol , dimisalkan ada gas seperti pada gambar di bawah. Tekanan system dijaga selalu konstan. Perumusan kedua pada kapasitas kalor tersebut secara matematis dapat dituliskan sebagai berikut. Efisiensi mesin otto memenuhi persamaan bab 12 gas dan termodinamika 1007 1 1 1 r 12.59 dengan r = v 2 v 1 adalah rasio volume ruang silinder saat piston dalam posisi terjauh dan tedekat dari dinding silinder = c p c v adalah koefisien adiabatik gambar 12.27 siklus otto yang dibentuk oleh dua buak proses adiabatik ab dan cd dan dua buah proses. Kalori adalah jumlah kalor yang diperlukan untuk menaikan suhu 1 gram air sebesar 1 co (tepatnya dari 14,5 oc menjadi 15,5 oc).
 Source: slideshare.net
Source: slideshare.net
Cp cv usaha yang dilakukan oleh sistem (gas) hanya mengubah energi dalam, sebab sistem tidak menerima ataupun melepas kalor. Secara matematis dapat dinyatakan dengan persamaan berikut : Untuk mengetahui hukum nol , dimisalkan ada gas seperti pada gambar di bawah. Kapasitas kalor gas sangat dipengaruhi oleh tekanan, namun pengaruh tekanan pada sifat termodinamika tidak digunakan dalam. Kapasitas kalor adalah banyaknya kalor yang diperlukan untuk menaikkan suhu sebesar 1 kelvin.
Situs ini adalah komunitas terbuka bagi pengguna untuk mencurahkan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini bagus, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga save halaman blog ini dengan judul hukum 1 termodinamika dan kapasitas kalor gas dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.