Grafik orde reaksi 0 1 2 3.
Jika kamu sedang mencari artikel grafik orde reaksi 0 1 2 3 terbaru, berarti kamu sudah berada di website yang benar. Yuk langsung saja kita simak ulasan grafik orde reaksi 0 1 2 3 berikut ini.
 Contoh Soal Dan Jawaban Kadar Tunak From jawabanbukunya.blogspot.com
Contoh Soal Dan Jawaban Kadar Tunak From jawabanbukunya.blogspot.com
Untuk orde satu, persamaan laju reaksi adalah :
Secara grafik, reaksi orde satu dapat. 2 (g) tentukan orde reaksi menggunakan hukum laju terintegrasi dari data berikut : Data pengukuran tiap waktu sesuai tabel berikut: 2y = 2 ® y = 1 (reaksi orde 1 terhadap br2) jadi rumus kecepatan reaksinya : No v 1 × 0,01 2 × 20,01 3 × 30,10 1 × 12 4 × 12 atau 2 × 12 9 × 12 atau 3 × 12
 Source: slideshare.net
Source: slideshare.net
2y = 2 ® y = 1 (reaksi orde 1 terhadap br2) jadi rumus kecepatan reaksinya : Untuk mencari orde [n], pilih konsentrasi [m] sama. Ternyata dalam 10 detik terbentuk 0,04 mol i 2. Pilih data 2 dan 1, untuk menentukan orde reaksi dari a, karena konsentrasi b tetap (sama) ([a 2]/[a 1]) n = v 2 /v 1 (2a/a) n = 64/16 2 n = 4 2 n = 2 2 n = 2 karena orde terhadap a adalah 2 maka. 2 v 1 × 0,10 2 × 0,10 3 × 0,10 1 × 12 2 × 12 3 × 12 jadi v ≈ [br 2]1 berarti reaksi orde 1 terhadap brom pada percobaan 1, 4 dan 5 konsentrasi brom tetap, konsentrasi no bervariasi, jadi variasi laju reaksi akibat dari variasi konsentrasi no.
2 al (s) + 3 h 2 so 2 (aq) → al 2 (so 4) 3 (aq) + 3h 2 (g).
Oven serbuk mno2 pada suhu 105°c selama 1 jam 3. V = k(no)2(br2) (reaksi orde 3) b. Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. T 1/2 = ln 2 / k = 0,693 / k (waktu paruh tidak bergantung pada konsentrasi awal reaktan) orde dua :
 Source: slideshare.net
Source: slideshare.net
Menaikkan konsentrasi 1 x akan menaikkan laju reaksi 2x & sebaliknya. Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. Contohnya, dalam reaksi ion arildiazonium dengan nukleofil dalam larutan berair arn 2 + + x − → arx + n 2, persamaannya adalah r = k[arn 2 +], dan ar merupakan kelompok aril. Persamaan reaksi orde satu merupakan persamaan linier berarti laju reaksi berbanding lurus terhadap konsentrasinya pereaksinya.
 Source: markasbelajar.blogspot.com
Source: markasbelajar.blogspot.com
Dari data ini terlihat konsentrasi br2 naik 2 kali, sedangkan kecepatan reaksinya naik 2 kali, maka : Contohnya, dalam reaksi ion arildiazonium dengan nukleofil dalam larutan berair arn 2 + + x − → arx + n 2, persamaannya adalah r = k[arn 2 +], dan ar merupakan kelompok aril. Pilih reaksi 4 dan 1. Jika konsentrasi pereaksinya dinaikkan misalnya 4 kali, maka laju reaksi akan menjadi 4 1 atau 4 kali lebih besar.
 Source: nafiun.com
Source: nafiun.com
Misalnya reaksi a(g) → b(g) memiliki orde reaksi 1 dan a(g) + 2b(g) → c(g) memiliki orde reaksi 1 + 2 = 3. Jika laju reaksi bergantung pada satu reaktan dan jumlah eksponennya satu, maka reaksi itu adalah reaksi orde pertama. Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. Dari percobaan 1, 2 dan 3, [no] dibuat tetap sedangkan [h 2] diperbesar sebesar 2 kali dari semula, ternyata laju reaksi naik dua kali, berarti laju reaksi berbanding lurus dengan [h 2].jadi, pada [no] tetap, laju reaksi (v) ≈ k [h 2] 1.pada percobaan 3, 4 dan 5, konsentrasi h 2 dibuat tetap, sedangkan konsentrasi no diturunkan/diperkecil sebesar dua kali dari semula, ternyata.
Contoh reaksi orde pertama lainnya adalah proses peluruhan.
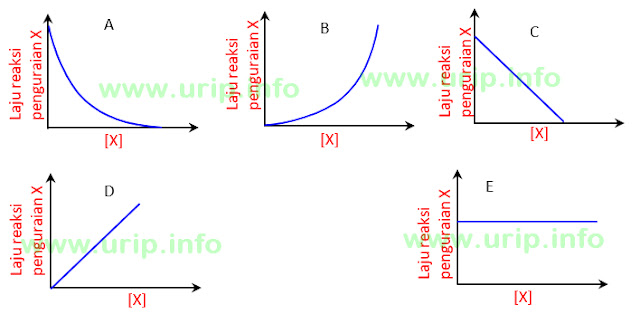
Grafik yang menyatakan reaksi orde satu adalah. No v 1 × 0,01 2 × 20,01 3 × 30,10 1 × 12 4 × 12 atau 2 × 12 9 × 12 atau 3 × 12 Untuk menentukan nilai k cukup kita ambil salah satu data percobaan saja misalnya data (1), maka: Ternyata dalam 10 detik terbentuk 0,04 mol i 2. V = k(no)2(br2) 12 = k(0.1)2(0.1.
 Source: nafiun.com
Source: nafiun.com
Dari percobaan 1, 2 dan 3, [no] dibuat tetap sedangkan [h 2] diperbesar sebesar 2 kali dari semula, ternyata laju reaksi naik dua kali, berarti laju reaksi berbanding lurus dengan [h 2].jadi, pada [no] tetap, laju reaksi (v) ≈ k [h 2] 1.pada percobaan 3, 4 dan 5, konsentrasi h 2 dibuat tetap, sedangkan konsentrasi no diturunkan/diperkecil sebesar dua kali dari semula, ternyata. Tempatkan serbuk mno2 pada labu erlenmeyer yang berisi h2o2. Pilih data 2 dan 1, untuk menentukan orde reaksi dari a, karena konsentrasi b tetap (sama) ([a 2]/[a 1]) n = v 2 /v 1 (2a/a) n = 64/16 2 n = 4 2 n = 2 2 n = 2 karena orde terhadap a adalah 2 maka. Preview this quiz on quizizz. Contoh reaksi orde pertama lainnya adalah proses peluruhan.
Orde reaksi kedua menunjukkan bahwa laju reaksi dipengaruhi oleh konsentrasi kedua reaktannya (v = k [a] [b]).
Laju perubahan konsentrasi h 2 o 2 adalah…. Pilih reaksi 4 dan 1. Jika konsentrasi pereaksinya dinaikkan misalnya 4 kali, maka laju reaksi akan menjadi 4 1 atau 4 kali lebih besar. Menaikkan konsentrasi 1 x akan menaikkan laju reaksi 2x & sebaliknya.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Pilih data 2 dan 1, untuk menentukan orde reaksi dari a, karena konsentrasi b tetap (sama) ([a 2]/[a 1]) n = v 2 /v 1 (2a/a) n = 64/16 2 n = 4 2 n = 2 2 n = 2 karena orde terhadap a adalah 2 maka. Penentuan orde reaksi terhadap a. Waktu (detik) 0.0 0.01000 50.0 0.00787 100.0 0.00649 200.0 0.00481 300.0 0.00380 karena reaksi dapat merupakan reaksi orde satu atau orde dua, maka dibuat grafik ln [no 2] dan 1/[no 2] terhadap waktu Gas hidrogen ditampung dan diukur volumenya paa temperatur yang tetap.
 Source: markasbelajar.blogspot.com
Source: markasbelajar.blogspot.com
Berdasarkan besar pengaruh konsentrasi reaktan, maka reaksi dapat dibedakan menjadi beberapa jenis yaitu reaksi orde nol, reaksi orde satu, reaksi. Grafik yang menyatakan reaksi orde satu adalah. 2y = 2 ® y = 1 (reaksi orde 1 terhadap br2) jadi rumus kecepatan reaksinya : Gas hidrogen ditampung dan diukur volumenya paa temperatur yang tetap.
 Source: nafiun.com
Source: nafiun.com
Oven serbuk mno2 pada suhu 105°c selama 1 jam 3. No v 1 × 0,01 2 × 20,01 3 × 30,10 1 × 12 4 × 12 atau 2 × 12 9 × 12 atau 3 × 12 Oven serbuk mno2 pada suhu 105°c selama 1 jam 3. Pilih data 2 dan 1, untuk menentukan orde reaksi dari a, karena konsentrasi b tetap (sama) ([a 2]/[a 1]) n = v 2 /v 1 (2a/a) n = 64/16 2 n = 4 2 n = 2 2 n = 2 karena orde terhadap a adalah 2 maka.
Orde reaksi =1 (orde satu) laju reaksi berbanding lurus dengan konsentrasi zat, jika konsentrasi pereaksi dilipattigakan maka laju reaksi akan menjadi 31 atau 3 kali lebih besar.
Contoh soal 5 (un 2015) pada percobaan reaksi antara logam alumunium dan asam sulfat sesuai persamaan reaksi: Soal pembahasan 5 menghitung orde waktu reaksi data percobaan pengukuran laju reaksi diperoleh data sebagai berikut: Jika konsentrasi pereaksinya dinaikkan misalnya 4 kali, maka laju reaksi akan menjadi 4 1 atau 4 kali lebih besar. Miringkan labu, tepat serbuk mno2 jatuh, jalankan stopwatch 6. Contoh soal 5 (un 2015) pada percobaan reaksi antara logam alumunium dan asam sulfat sesuai persamaan reaksi:
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
2 al (s) + 3 h 2 so 2 (aq) → al 2 (so 4) 3 (aq) + 3h 2 (g). Menaikkan konsentrasi 1x akan menaikkan laju reaksi 1x & sebaliknya. Orde reaksi [n] sama dengan y=0 orde reaksi totalnya x+y=1+0=1. Orde keseluruhan reaksi tersebut adalah. Dari percobaan 1, 2 dan 3, [no] dibuat tetap sedangkan [h 2] diperbesar sebesar 2 kali dari semula, ternyata laju reaksi naik dua kali, berarti laju reaksi berbanding lurus dengan [h 2].jadi, pada [no] tetap, laju reaksi (v) ≈ k [h 2] 1.pada percobaan 3, 4 dan 5, konsentrasi h 2 dibuat tetap, sedangkan konsentrasi no diturunkan/diperkecil sebesar dua kali dari semula, ternyata.
Orde keseluruhan reaksi tersebut adalah.
Ukurlah 100ml h2o2 0,3% dan tuangkan ke dalam labu erlenmeyer 100 ml 5. Tingkat reaksi total adalah jumlah total dari tingkat reaksi semua pereaksi. T 1/2 = 1 / k.[a] 0 (waktu paruh berbanding terbalik dengan konsentarsi awal reaktan) Penentuan orde reaksi terhadap a.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
2 al (s) + 3 h 2 so 2 (aq) → al 2 (so 4) 3 (aq) + 3h 2 (g). Tempatkan serbuk mno2 pada labu erlenmeyer yang berisi h2o2. V = k(no)2(br2) 12 = k(0.1)2(0.1. Dari percobaan 1, 2 dan 3, [no] dibuat tetap sedangkan [h 2] diperbesar sebesar 2 kali dari semula, ternyata laju reaksi naik dua kali, berarti laju reaksi berbanding lurus dengan [h 2].jadi, pada [no] tetap, laju reaksi (v) ≈ k [h 2] 1.pada percobaan 3, 4 dan 5, konsentrasi h 2 dibuat tetap, sedangkan konsentrasi no diturunkan/diperkecil sebesar dua kali dari semula, ternyata.
 Source: slideshare.net
Source: slideshare.net
Dari kedua plot (orde 0 dan orde 1) maka diperoleh : Pilih reaksi 4 dan 1. Laju perubahan konsentrasi h 2 o 2 adalah…. Secara grafik, reaksi orde satu dapat.
 Source: brainly.co.id
Source: brainly.co.id
Untuk reaksi yang kompleks, orde reaksi harus ditentukan berdasarkan data percobaan. 2 v 1 × 0,10 2 × 0,10 3 × 0,10 1 × 12 2 × 12 3 × 12 jadi v ≈ [br 2]1 berarti reaksi orde 1 terhadap brom pada percobaan 1, 4 dan 5 konsentrasi brom tetap, konsentrasi no bervariasi, jadi variasi laju reaksi akibat dari variasi konsentrasi no. Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. Secara grafik, reaksi orde satu dapat.
Tempatkan serbuk mno2 pada labu erlenmeyer yang berisi h2o2.
Misalnya reaksi a(g) → b(g) memiliki orde reaksi 1 dan a(g) + 2b(g) → c(g) memiliki orde reaksi 1 + 2 = 3. 2 v 1 × 0,10 2 × 0,10 3 × 0,10 1 × 12 2 × 12 3 × 12 jadi v ≈ [br 2]1 berarti reaksi orde 1 terhadap brom pada percobaan 1, 4 dan 5 konsentrasi brom tetap, konsentrasi no bervariasi, jadi variasi laju reaksi akibat dari variasi konsentrasi no. No v 1 × 0,01 2 × 20,01 3 × 30,10 1 × 12 4 × 12 atau 2 × 12 9 × 12 atau 3 × 12 Orde reaksi adalah bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. Misalnya reaksi a(g) → b(g) memiliki orde reaksi 1 dan a(g) + 2b(g) → c(g) memiliki orde reaksi 1 + 2 = 3.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Menaikkan konsentrasi 1 x akan menaikkan laju reaksi 2x & sebaliknya. Grafik yang menyatakan reaksi orde satu adalah. Untuk mencari orde [n], pilih konsentrasi [m] sama. Orde reaksi =0 (orde nol) laju reaksi tidak dipengaruhi oleh konsentrasi zat. Ukurlah 100ml h2o2 0,3% dan tuangkan ke dalam labu erlenmeyer 100 ml 5.
Dari data ini terlihat konsentrasi br2 naik 2 kali, sedangkan kecepatan reaksinya naik 2 kali, maka :
Jika konsentrasi pereaksinya dinaikkan misalnya 4 kali, maka laju reaksi akan menjadi 4 1 atau 4 kali lebih besar. Contoh reaksi orde pertama lainnya adalah proses peluruhan. Orde reaksi =0 (orde nol) laju reaksi tidak dipengaruhi oleh konsentrasi zat. Soal pembahasan 5 menghitung orde waktu reaksi data percobaan pengukuran laju reaksi diperoleh data sebagai berikut:
 Source: brainly.co.id
Source: brainly.co.id
Menaikkan konsentrasi 1x akan menaikkan laju reaksi 1x & sebaliknya. Tempatkan serbuk mno2 pada labu erlenmeyer yang berisi h2o2. Dari kedua plot (orde 0 dan orde 1) maka diperoleh : Menaikkan konsentrasi 1 x akan menaikkan laju reaksi 2x & sebaliknya. Orde reaksi [n] sama dengan y=0 orde reaksi totalnya x+y=1+0=1.
 Source: nafiun.com
Source: nafiun.com
No v 1 × 0,01 2 × 20,01 3 × 30,10 1 × 12 4 × 12 atau 2 × 12 9 × 12 atau 3 × 12 Persamaan reaksi orde satu merupakan persamaan linier berarti laju reaksi berbanding lurus terhadap konsentrasinya pereaksinya. Dari data ini terlihat konsentrasi br2 naik 2 kali, sedangkan kecepatan reaksinya naik 2 kali, maka : Artinya, jika konsentrasi pereaksi dinaikkan dua kali semula, maka laju reaksi juga akan meningkat besarnya sebanyak (2) 1 atau 2 kali semula juga. V = k(no)2(br2) (reaksi orde 3) b.
 Source: jawabanbukunya.blogspot.com
Source: jawabanbukunya.blogspot.com
Orde reaksi =1 (orde satu) laju reaksi berbanding lurus dengan konsentrasi zat, jika konsentrasi pereaksi dilipattigakan maka laju reaksi akan menjadi 31 atau 3 kali lebih besar. Preview this quiz on quizizz. Dari kedua plot (orde 0 dan orde 1) maka diperoleh : Contohnya, dalam reaksi ion arildiazonium dengan nukleofil dalam larutan berair arn 2 + + x − → arx + n 2, persamaannya adalah r = k[arn 2 +], dan ar merupakan kelompok aril. Dari percobaan 1, 2 dan 3, [no] dibuat tetap sedangkan [h 2] diperbesar sebesar 2 kali dari semula, ternyata laju reaksi naik dua kali, berarti laju reaksi berbanding lurus dengan [h 2].jadi, pada [no] tetap, laju reaksi (v) ≈ k [h 2] 1.pada percobaan 3, 4 dan 5, konsentrasi h 2 dibuat tetap, sedangkan konsentrasi no diturunkan/diperkecil sebesar dua kali dari semula, ternyata.
Situs ini adalah komunitas terbuka bagi pengguna untuk mencurahkan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini baik, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga bookmark halaman blog ini dengan judul grafik orde reaksi 0 1 2 3 dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.





