Cu no3 cu2 no2 setengah reaksi.
Jika kamu sedang mencari artikel cu no3 cu2 no2 setengah reaksi terlengkap, berarti kamu telah berada di website yang tepat. Yuk langsung aja kita simak ulasan cu no3 cu2 no2 setengah reaksi berikut ini.
 CopperEinsteins Part A Cu(s)+4HNO3(aq)=2H2O(aq)+2NO2(g From coppereinsteins.blogspot.com
CopperEinsteins Part A Cu(s)+4HNO3(aq)=2H2O(aq)+2NO2(g From coppereinsteins.blogspot.com
Reaksi redoks dalam sel elektrokimia sel elektrokimia ada 2 macam, yakni sel volta dan sel elektrolisis.
Ketika reaksi berlangsung, dalam larutan zn(no3)2 akan kelebihan ion zn2+ (hasil oksidasi). K2cr2o7 + h2so4 + ch3ch2oh k2so4 + cr2(so4)3 + ch3cooh + h2o 2. Samakan jumlah atom o dengan menambahkan h 2 o di yang kurang o sebanyak kekurangannya (suasana asam), atau menambahkan h 2 o di yang lebih o sebanyak kelebihannya (suasana basa).; Cu → cu2+ langkah 3, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat. Aturan dasar untuk menyetarakan reaksi redoks metode setengah.
 Source: regnominerale.it
Source: regnominerale.it
Tahap 1, kita tentukan reaksi ionnya. Kelebihan elektron pada elektrode cu akan diterima oleh ion cu2+ yang disediakan oleh larutan cu(no3)2 sehingga terjadi reduksi ion cu2+ menjadi cu(s). Karena jumlah atom n dan cu sudah setara, tidak ada yang perlu dilakukan reduksi: Setarakan reaksi redoks berikut dengan cara setengah reaksi : Cu → cu2+ langkah 4, setarakan oksigen (o) dengan menambahkan h2o ke ruas yang kekurangan o reduksi:
Oksidasi= cu ——> cu +2.
(suasana asam) cu (s) + hno 3(aq) → cu(no 3) 2(aq) + no (g) + h 2 o (l) jawaban: Setarakan reaksi redoks berikut dengan cara setengah reaksi : Samakan jumlah unsur yang berubah biloks. Aturan dasar untuk menyetarakan reaksi redoks metode setengah.
 Source: pinterest.com
Source: pinterest.com
Semua reaksi terjadi dalam suasana asam. Samakan jumlah unsur yang berubah biloks. Bagi reaksi menjadi 2, satu reduksi dan satu oksidasi; Cu → cu2+ langkah 3, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
 Source: coppereinsteins.blogspot.com
Source: coppereinsteins.blogspot.com
Harga koefisien reaksi untuk a, b dan c berturut turut adalah. Harga koefisien reaksi untuk a, b dan c berturut turut adalah. Cu + hno3 → cu(no3)2 + no2 + h2o dengan cara bilangan oksidasi. K2cr2o7 + h2so4 + ch3ch2oh k2so4 + cr2(so4)3 + ch3cooh + h2o 2.
 Source: regnominerale.it
Source: regnominerale.it
Cu → cu2+ langkah 4, setarakan oksigen (o) dengan menambahkan h2o ke ruas yang kekurangan o reduksi: (suasana asam) cu (s) + hno 3(aq) → cu(no 3) 2(aq) + no (g) + h 2 o (l) jawaban: Cu → cu2+ langkah 3, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat. Cu(s) + hno3(aq) → cu(no3)2(aq) + no(g) + h2o(l) (asam) jawab:
Pengertian reaksi oksidasi dan reaksi reduksi berkembang sesuai dengan.
Cu + hno3 → cu(no3)2 + no2 + h2o dengan cara bilangan oksidasi. Setarakan reaksi redoks berikut dengan cara setengah reaksi : Kelebihan elektron pada elektrode cu akan diterima oleh ion cu2+ yang disediakan oleh larutan cu(no3)2 sehingga terjadi reduksi ion cu2+ menjadi cu(s). Pengertian reaksi oksidasi dan reaksi reduksi berkembang sesuai dengan. O= cu ——> cu +2 ( tidak ditambahkan h2o karena tidak ada atom o )
 Source: slideshare.net
Source: slideshare.net
Sel elektrokimia merupakan suatu sistem yang terdiri atas dua elektroda, dan larutan atau leburan elektrolit sebagai penghantar elektron. Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi. Cu → cu2+ langkah 5, setarakan hidrogen (h) dengan menambahkan h+ ke ruas yang kekurangan atom h reduksi: Kelebihan elektron pada elektrode cu akan diterima oleh ion cu2+ yang disediakan oleh larutan cu(no3)2 sehingga terjadi reduksi ion cu2+ menjadi cu(s). (suasana asam) cu (s) + hno 3(aq) → cu(no 3) 2(aq) + no (g) + h 2 o (l) jawaban:
Setarakan reaksi berikut menggunakan metode setengah reaksi!
Reaksi redoks dalam sel elektrokimia sel elektrokimia ada 2 macam, yakni sel volta dan sel elektrolisis. As2s5 + hno3 h3aso4 + h2so4 + no2 + h2o e. Semua reaksi terjadi dalam suasana asam. Setarakan reaksi redoks berikut dengan cara setengah reaksi :
 Source: regnominerale.it
Source: regnominerale.it
3 cus + 2 no₃⁻ + 8 h⁺ ==> 3 cu⁺² + 3 s + 2 no + 4 h₂o. Cu → cu2+ langkah 5, setarakan hidrogen (h) dengan menambahkan h+ ke ruas yang kekurangan atom h reduksi: Ketika reaksi berlangsung, dalam larutan zn(no3)2 akan kelebihan ion zn2+ (hasil oksidasi). As2s5 + hno3 h3aso4 + h2so4 + no2 + h2o e.
 Source: coppereinsteins.blogspot.com
Source: coppereinsteins.blogspot.com
As2s5 + hno3 + h2o → h3aso3 + no + s psg rayon 1 24 universitas negeri makassar dengan cara bilangan oksidasi. Tentukan reaksi setengah sel ( reaksi oksidasi dan reduksi ) b. Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan). Oksidasi= cu ——> cu +2.
 Source: slideshare.net
Source: slideshare.net
Reaksi redoks dalam sel elektrokimia sel elektrokimia ada 2 macam, yakni sel volta dan sel elektrolisis. Menjumlahkan kedua pasangan setengah reaksi. 3 cus + 2 no₃⁻ + 8 h⁺ ==> 3 cu⁺² + 3 s + 2 no + 4 h₂o. Sel elektrokimia merupakan suatu sistem yang terdiri atas dua elektroda, dan larutan atau leburan elektrolit sebagai penghantar elektron.
Hasil penjumlahan reaksi oksidasi dan reduksi.
Kelebihan elektron pada elektrode cu akan diterima oleh ion cu2+ yang disediakan oleh larutan cu(no3)2 sehingga terjadi reduksi ion cu2+ menjadi cu(s). Karena jumlah atom n dan cu sudah setara, tidak ada yang perlu dilakukan reduksi: Samakan jumlah unsur yang berubah biloks. Pengertian reaksi oksidasi dan reaksi reduksi berkembang sesuai dengan. Harga koefisien reaksi untuk a, b dan c berturut turut adalah.
 Source: pinterest.com
Source: pinterest.com
Cu → cu2+ langkah 5, setarakan hidrogen (h) dengan menambahkan h+ ke ruas yang kekurangan atom h reduksi: Cara ii metode setengah reaksi. Oksidasi= cu ——> cu +2. Setarakan reaksi berikut menggunakan metode setengah reaksi! Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi.
Bagi reaksi menjadi 2, satu reduksi dan satu oksidasi;
Cu → cu2+ langkah 3, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat. Setarakan reaksi tersebut menggunakan metode setengah reaksi dalam suasana asam ! Karena jumlah atom n dan cu sudah setara, tidak ada yang perlu dilakukan reduksi: Cu → cu2+ langkah 5, setarakan hidrogen (h) dengan menambahkan h+ ke ruas yang kekurangan atom h reduksi:
 Source: youtube.com
Source: youtube.com
Tentukan reaksi setengah sel ( reaksi oksidasi dan reduksi ) b. Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan). Bagi reaksi menjadi 2, satu reduksi dan satu oksidasi; (suasana asam) cu (s) + hno 3(aq) → cu(no 3) 2(aq) + no (g) + h 2 o (l) jawaban:
 Source: pinterest.com
Source: pinterest.com
Cara ii metode setengah reaksi. 3 cus + 2 no₃⁻ + 8 h⁺ ==> 3 cu⁺² + 3 s + 2 no + 4 h₂o. Samakan jumlah unsur yang berubah biloks. Soal ulangan harian reaksi redoks dan penerapannya + kunci jawaban.
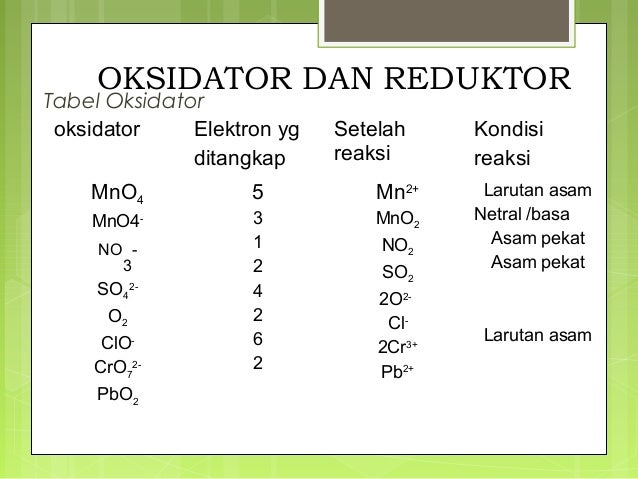 Source: slideshare.net
Source: slideshare.net
Reaksi redoks dalam sel elektrokimia sel elektrokimia ada 2 macam, yakni sel volta dan sel elektrolisis. O= cu ——> cu +2 ( tidak ditambahkan h2o karena tidak ada atom o ) Kelebihan elektron pada elektrode cu akan diterima oleh ion cu2+ yang disediakan oleh larutan cu(no3)2 sehingga terjadi reduksi ion cu2+ menjadi cu(s). Oleh karena itu, pada reaksi mg (s) + o2 (g), magnesium dioksidasi dan oksigen direduksi.
Samakan jumlah unsur yang berubah biloks.
As2s5 + hno3 + h2o → h3aso3 + no + s psg rayon 1 24 universitas negeri makassar dengan cara bilangan oksidasi. Setarakan reaksi redoks berikut dengan cara setengah reaksi : Cu → cu2+ langkah 4, setarakan oksigen (o) dengan menambahkan h2o ke ruas yang kekurangan o reduksi: Aturan dasar untuk menyetarakan reaksi redoks metode setengah. Ion atau molekul dibawah ini yang tidak dapat mengalami rekasi disproporsionasi adalah.
 Source: coppereinsteins.blogspot.com
Source: coppereinsteins.blogspot.com
Samakan jumlah unsur yang berubah biloks. 45+ soal penyetaraan reaksi redoks pilihan ganda [+pembahasan] oleh anas ilham diposting pada mei 9, 2021. Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan). Setarakan reaksi tersebut menggunakan metode setengah reaksi dalam suasana asam ! Kelebihan elektron pada elektrode cu akan diterima oleh ion cu2+ yang disediakan oleh larutan cu(no3)2 sehingga terjadi reduksi ion cu2+ menjadi cu(s).
Cu → cu2+ langkah 5, setarakan hidrogen (h) dengan menambahkan h+ ke ruas yang kekurangan atom h reduksi:
Cu → cu2+ langkah 5, setarakan hidrogen (h) dengan menambahkan h+ ke ruas yang kekurangan atom h reduksi: As2s5 + hno3 h3aso4 + h2so4 + no2 + h2o e. Bagi reaksi menjadi 2, satu reduksi dan satu oksidasi; Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan).
 Source: slideshare.net
Source: slideshare.net
Semua reaksi terjadi dalam suasana asam. K2cr2o7 + h2so4 + ch3ch2oh k2so4 + cr2(so4)3 + ch3cooh + h2o 2. Cu → cu2+ langkah 4, setarakan oksigen (o) dengan menambahkan h2o ke ruas yang kekurangan o reduksi: Pada setiap reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan (simultan). As2s5 + hno3 h3aso4 + h2so4 + no2 + h2o e.
 Source: coppereinsteins.blogspot.com
Source: coppereinsteins.blogspot.com
Setarakan reaksi tersebut menggunakan metode setengah reaksi dalam suasana asam ! As2s5 + hno3 h3aso4 + h2so4 + no2 + h2o e. Oksidasi= cu ——> cu +2. Aturan dasar untuk menyetarakan reaksi redoks metode setengah. O= cu ——> cu +2 ( tidak ditambahkan h2o karena tidak ada atom o )
 Source: pinterest.com
Source: pinterest.com
Cu → cu2+ langkah 4, setarakan oksigen (o) dengan menambahkan h2o ke ruas yang kekurangan o reduksi: Cu(s) + hno3(aq) → cu(no3)2(aq) + no(g) + h2o(l) (asam) jawab: Karena jumlah atom n dan cu sudah setara, tidak ada yang perlu dilakukan reduksi: Soal ulangan harian reaksi redoks dan penerapannya + kunci jawaban. As2s5 + hno3 + h2o → h3aso3 + no + s psg rayon 1 24 universitas negeri makassar dengan cara bilangan oksidasi.
Situs ini adalah komunitas terbuka bagi pengguna untuk mencurahkan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini bagus, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga save halaman blog ini dengan judul cu no3 cu2 no2 setengah reaksi dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.