Contoh konfigurasi elektron dalam keadaan dasar.
Jika kamu mencari artikel contoh konfigurasi elektron dalam keadaan dasar terbaru, berarti kamu telah berada di blog yang benar. Yuk langsung saja kita simak pembahasan contoh konfigurasi elektron dalam keadaan dasar berikut ini.
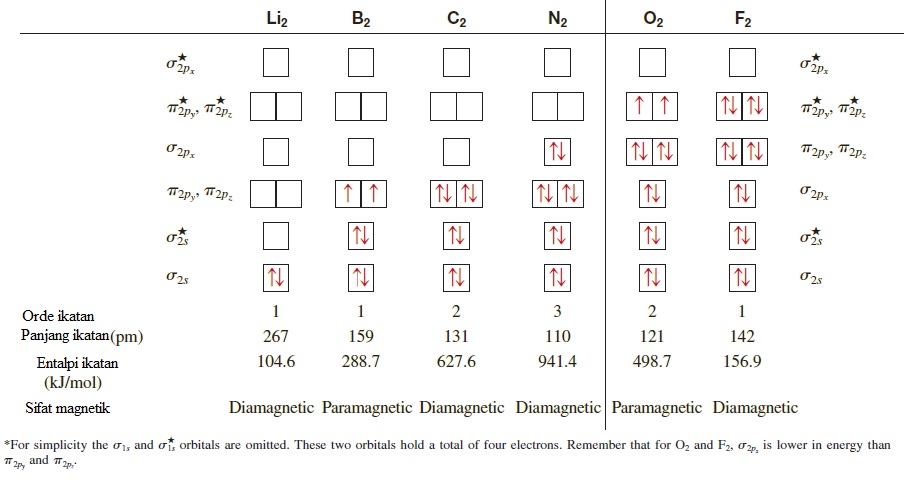 10.7 Konfigurasi Orbital Molekul PENGEMBANGAN MEDIA From chem.co.id
10.7 Konfigurasi Orbital Molekul PENGEMBANGAN MEDIA From chem.co.id
Ketika membentuk konfigurasi elektron, penempatan elektron dalam orbital dimulai dengan tingkat energi terendah mengikuti aturan aufbau, konfigurasi elektron dengan jumlah elektron pada setiap orbitalnya menjadi:
Konfigurasi elektron untuk ni (z=28) yaitu 1s22s22p63s23p64s23d8 atau bisa ditulis dengan [ar] 4s23d8dengan k=2, l=8, m=16, dan n=2. Coba nih lihat contoh konfigurasi elektron atom karbon. Misal, diketahui ni (z=28) dan sr (z=38). Dari konfigurasi elektron atom karbon pada keadaan dasar diketahui bahwa, jika atom karbon menggunakan orbital asli pada pembentukan ikatan maka hanya terbentuk ch2, yakni tumpang tindih antara orbital 2px dan 2py dari atom karbon dengan 2 orbital 1s dari 2 atom hidrogen. Saat menuliskan konfigurasi elektron, kita harus menuliskannya secara urut berdasarkan tingkat energi subkulit dari yang terendah ke tertinggi.
 Source: materikimia.com
Source: materikimia.com
Jika satu elektron pada orbital 2s dipindahkan ke orbital 2p maka akan terjadi keadaan tereksitasi karena tingkat energi 2p lebih kuat ketimbang 2s. 1s 2 2s 2 2p 6 3s 2. 1s 2 2s 2 2p 6 3s 1; 1s 2 2s 2 2p 6 3s2 3p 6 4s 1 3d 5 (menyimpang dari aturan aufbau karena lebih stabil dengan keadaan subkulit s dan d terisi setengah penuh) jadi, konfigurasi elektron unsur y pada. Tingkat yang lebih tinggi n ≥ 2 disebut sebagai keadaan tereksitasi.
Co = 27, se = 34) dari diagram.
Sebagai contoh, keadaan dasar konfigurasi atom sodium adalah 1s 2 2s 2 2p 6 3s, yang berasal dari prinsip aufbau. 1s 2 2s 2 2p 1; Co = 27, se = 34) dari diagram. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1
 Source: materikimia.com
Source: materikimia.com
Sedangkan konfigurasi lainnya disebut keadaan tereksitasi (excited state). Misal, diketahui ni (z=28) dan sr (z=38). Berikut adalah beberapa contoh untuk mencari konfigurasi elektron. Coba nih lihat contoh konfigurasi elektron atom karbon.
 Source: chem.co.id
Source: chem.co.id
State dan meny alahi aturan konfigurasi elektron dap at terjadi seandainya elektron menerima energi dari luar m isalnya dalam bentuk ra diasi atau kalor. Berikut adalah beberapa contoh untuk mencari konfigurasi elektron. Selama elektron itu berada dalam keadaan energi terendah (yang disebut keadaan dasar), elektron itu akan berada di tingkat energi pertama, yang hanya memiliki satu subtingkat: Co = 27, se = 34) dari diagram.
Konfigurasi elektron dari setiap atom direpresentasikan sesuai dengan posisinya pada tabel periodik.
Seng dengan simbol kimia zn memiliki nomor atom 30, yang berarti memiliki 30 proton dalam intinya. Berikut adalah beberapa contoh untuk mencari konfigurasi elektron. Apa konfigurasi elektron keadaan dasar untuk zn? Zn(z = 30) = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2. Sebagai contoh, keadaan dasar konfigurasi atom sodium adalah 1s 2 2s 2 2p 6 3s, yang berasal dari prinsip aufbau.
 Source: chem.co.id
Source: chem.co.id
Berikut konfigurasi elektron atom c pada keadaan dasar. Apa konfigurasi elektron keadaan dasar untuk zn? Konfigurasi dasar sulfur dengan no. 1s 2 2s 2 2p 6 3 s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6. Tabel konfigurasi elektron lengkap 172 unsur.
Konfigurasi elektron pada keadaan dasar adalah konfigurasi elektron yang sesuai dengan prinsip aufbau.
Konfigurasi elektron pada keadaan dasar adalah konfigurasi elektron yang sesuai dengan prinsip aufbau. Misal, diketahui ni (z=28) dan sr (z=38). 1s 2 2s 2 2p 6 3s 2 3p 6; Jika satu elektron pada orbital 2s dipindahkan ke orbital 2p maka akan terjadi keadaan tereksitasi karena tingkat energi 2p lebih kuat ketimbang 2s.
 Source: materikimia.com
Source: materikimia.com
Jika satu elektron pada orbital 2s dipindahkan ke orbital 2p maka akan terjadi keadaan tereksitasi karena tingkat energi 2p lebih kuat ketimbang 2s. Contoh yang menunjukkan pelanggaran aturan hund, pelanggaran prinsip pengecualian paul, diagram orbital dalam keadaan dasar, diagram orbital dalam keadaan tereksitasi, dan pelanggaran prinsip aufbau yaitu sebagai berikut. Saat menuliskan konfigurasi elektron, kita harus menuliskannya secara urut berdasarkan tingkat energi subkulit dari yang terendah ke tertinggi. Konfigurasi dasar sulfur dengan no.
 Source: chem.co.id
Source: chem.co.id
Zn(z = 30) = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2. Tingkat yang lebih tinggi n ≥ 2 disebut sebagai keadaan tereksitasi. Misal, diketahui ni (z=28) dan sr (z=38). Tingkat keadaan elektron pada n = 1 adalah tingkat energi terendah dan disebut sebagai keadaan dasar.
Energi juga dapat dikaitkan dengan elektron dalam orbital.
Superscript, yang dalam hal ini adalah 1, menunjukkan jumlah elektron hadir dalam 1s sublevel. Tingkat yang lebih tinggi n ≥ 2 disebut sebagai keadaan tereksitasi. Sebagai contoh, keadaan dasar konfigurasi atom sodium adalah 1s 2 2s 2 2p 6 3s, yang berasal dari prinsip aufbau. 1s 2 2s 2 2p 6 3s2 3p 6 4s 1 3d 5 (menyimpang dari aturan aufbau karena lebih stabil dengan keadaan subkulit s dan d terisi setengah penuh) jadi, konfigurasi elektron unsur y pada. Subkulit s maksimal terisi 2 elektron , p terisi 6 elektron (p 6), d terisi 10 elektron , dan f terisi 14 elektron.
 Source: chem.co.id
Source: chem.co.id
Ketika membentuk konfigurasi elektron, penempatan elektron dalam orbital dimulai dengan tingkat energi terendah mengikuti aturan aufbau, konfigurasi elektron dengan jumlah elektron pada setiap orbitalnya menjadi: Misal, diketahui ni (z=28) dan sr (z=38). 1s 2 2s 2 2p 6 3s2 3p 6 4s 1 3d 5 (menyimpang dari aturan aufbau karena lebih stabil dengan keadaan subkulit s dan d terisi setengah penuh) jadi, konfigurasi elektron unsur y pada. Energi dalam sebuah konfigurasi sering kali mendekati jumlah energi di setiap elektron dengan mengabaikan interaksi antar elektron. Tabel konfigurasi elektron lengkap 172 unsur.
Konfigurasi elektron dari setiap atom direpresentasikan sesuai dengan posisinya pada tabel periodik.
Dari konfigurasi elektron atom karbon pada keadaan dasar diketahui bahwa, jika atom karbon menggunakan orbital asli pada pembentukan ikatan maka hanya terbentuk ch2, yakni tumpang tindih antara orbital 2px dan 2py dari atom karbon dengan 2 orbital 1s dari 2 atom hidrogen. Misal, diketahui ni (z=28) dan sr (z=38). 1s 2 2s 2 2p 6 3s 2 3p 5; Subkulit s maksimal terisi 2 elektron , p terisi 6 elektron (p 6), d terisi 10 elektron , dan f terisi 14 elektron.
 Source: materikimia.com
Source: materikimia.com
Misal, diketahui ni (z=28) dan sr (z=38). Apa konfigurasi elektron keadaan dasar untuk zn? Berikut konfigurasi elektron atom c pada keadaan dasar. Contohnya, diagram orbital atom c dalam keadaan dasar adalah sebagai berikut:
 Source: chem.co.id
Source: chem.co.id
Konfigurasi elektron untuk ni (z=28) yaitu 1s22s22p63s23p64s23d8 atau bisa ditulis dengan [ar] 4s23d8dengan k=2, l=8, m=16, dan n=2. Konfigurasi dasar sulfur dengan no. Energi juga dapat dikaitkan dengan elektron dalam orbital. 1s 2 2s 2 2p 6 3 s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6.
Tingkat yang lebih tinggi n ≥ 2 disebut sebagai keadaan tereksitasi.
Contohnya, diagram orbital atom c dalam keadaan dasar adalah sebagai berikut: Subkulit s maksimal terisi 2 elektron , p terisi 6 elektron (p 6), d terisi 10 elektron , dan f terisi 14 elektron. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 Konfigurasi yang memiliki energi terendah disebut keadaan dasar (ground state). Misal, diketahui ni (z=28) dan sr (z=38).
 Source: materikimia.com
Source: materikimia.com
Contohnya, diagram orbital atom c dalam keadaan dasar adalah sebagai berikut: State dan meny alahi aturan konfigurasi elektron dap at terjadi seandainya elektron menerima energi dari luar m isalnya dalam bentuk ra diasi atau kalor. Sedangkan konfigurasi lainnya disebut keadaan tereksitasi (excited state). 1s 2 2s 2 2p 6 3s 1; Konfigurasi elektron untuk ni (z=28) yaitu 1s22s22p63s23p64s23d8 atau bisa ditulis dengan [ar] 4s23d8dengan k=2, l=8, m=16, dan n=2.
Sedangkan konfigurasi lainnya disebut keadaan tereksitasi (excited state).
1s 2 2s 2 2p 6 3s 2. Contohnya, diagram orbital atom c dalam keadaan dasar adalah sebagai berikut: 1s 2 2s 2 2p 6 3s 2. Misal, diketahui ni (z=28) dan sr (z=38).
 Source: materikimia.com
Source: materikimia.com
Tabel konfigurasi elektron lengkap 172 unsur. Zn(z = 30) = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2. Keadaan tereksitasi pertama diperoleh dengan menukar elektron 3s menjadi 3p sehingga menjadi 1s 2 2s 2 2p 6 3p yang dapat disingkat menjadi level 3p. Coba nih lihat contoh konfigurasi elektron atom karbon. Unsur dengan keelektronegatifan tinggi mempunyai konfigurasi elektron pada keadaan dasar adalah.
 Source: chem.co.id
Source: chem.co.id
State dan meny alahi aturan konfigurasi elektron dap at terjadi seandainya elektron menerima energi dari luar m isalnya dalam bentuk ra diasi atau kalor. 1s 2 2s 2 2p 6 3s 2 3p 5; Berikut konfigurasi elektron atom c pada keadaan dasar. Konfigurasi elektron hidrogen kemudian ditulis sebagai 1s 1. Konfigurasi yang memiliki energi terendah disebut keadaan dasar (ground state).
Situs ini adalah komunitas terbuka bagi pengguna untuk berbagi apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini lengkap, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga bookmark halaman blog ini dengan judul contoh konfigurasi elektron dalam keadaan dasar dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.





