Apa yang dimaksud dengan pereaksi pembatas.
Jika kamu mencari artikel apa yang dimaksud dengan pereaksi pembatas terbaru, berarti kamu telah berada di blog yang tepat. Yuk langsung aja kita simak pembahasan apa yang dimaksud dengan pereaksi pembatas berikut ini.
 Apa yang dimaksud dengan Ikatan Ion? From blog.ruangguru.com
Ini adalah zat yang memungkinkan keberadaan zat yang berbeda untuk ditunjukkan yang, melalui interaksi, dapat menghasilkan produk baru.
Pereaksi yang sisa adalah h 2 so 4 c. Pereaksi pembatas dan pereaksi berlebih dalam reaksi kimia dapat ditemukan ketika kita mereaksikan dua zat atau lebih, namun ada salah satu zat yang habis terlebih dahulu. Pereaksi pembatas (limiting reactant) = zat pereaksi yang habis bereaksi lebih dahulu, dan menjadi penentu jumlah produk yang dihasilkan. Massa pereaksi sisa (o 2) = n x mr o 2 = 0,5 x 32 = 16 gram Di bidang kimia kita tahu dengan nama pereaksi zat yang bertanggung jawab untuk menghasilkan reaksi kimia.
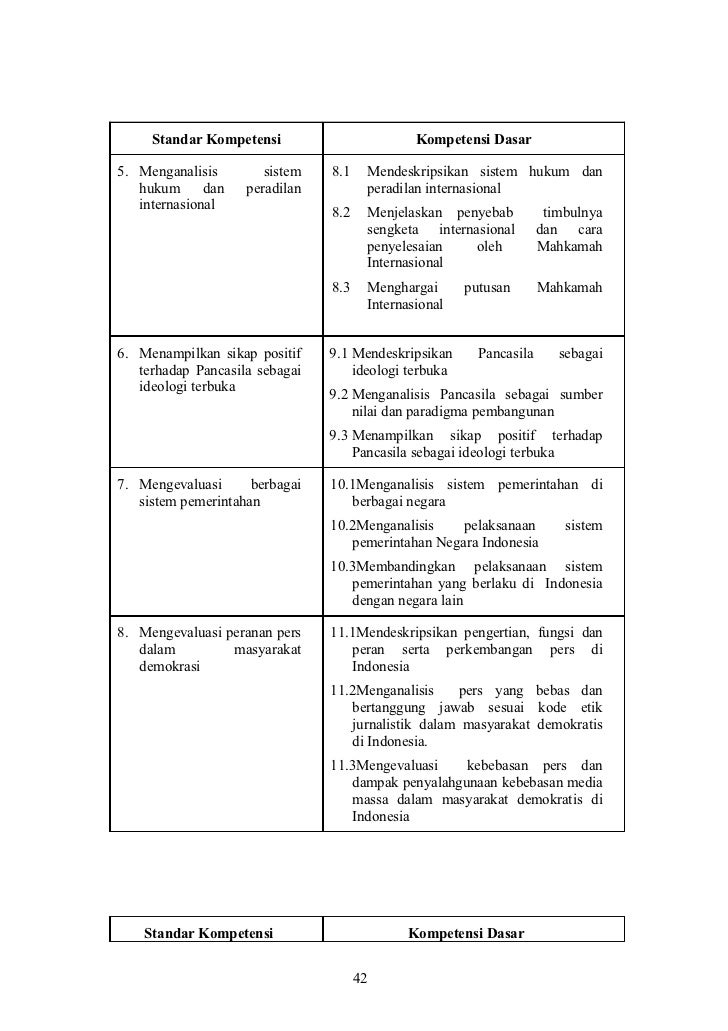
 Source: brainly.co.id
Source: brainly.co.id
Volume gas co 2 dihasilkan = n x 22,4 liter = 1 x 22,4 = 22,4 liter. •cari apa yang ditanyakan catatan : Pereaksi pembatas (limiting reactant) = zat pereaksi yang habis bereaksi lebih dahulu, dan menjadi penentu jumlah produk yang dihasilkan. Pereaksi yang habis bereaksi (pereaksi pembatas) adalah pereaksi yang jumlah molnya terkecil, yaitu h 2. Jika zat lain yang bereaksi masih ada sisa setelah bereaksi dengan pereaksi pembatas, maka zat tersebut disebut sebagai pereaksi berlebih (excess reactant).
Ini adalah zat yang memungkinkan keberadaan zat yang berbeda untuk ditunjukkan yang,.
Pereaksi yang berlebih adalah reaktan yang tidak sepenuhnya habis digunakan selama reaksi kimia, dengan kata lain ada beberapa dari reaktan yang tersisa setelah reaksi. Ini adalah zat yang memungkinkan keberadaan zat yang berbeda untuk ditunjukkan yang,. Sebelum membahas lebih lanjut, mari perhatikan daftar isi berikut. Memilih pereaksi yang digunakan sebagai pembatas dan yang berlebih.
 Source: brainly.co.id
Source: brainly.co.id
Memilih pereaksi yang digunakan sebagai pembatas dan yang berlebih. Pereaksi yang habis bereaksi (pereaksi pembatas) adalah pereaksi yang jumlah molnya terkecil, yaitu h 2. Sedangkan pereaksi berlebih (excess) = pereaksi yang jumlahnya melebihi dari jumlah yang dibutuhkan. •cari apa yang ditanyakan catatan :
 Source: dictio.id
Source: dictio.id
Hasil bagi yang terkecil merupakan pereaksi pembatas jika hasil bagi sama maka kedua pereaksi habis bereaksi 4. Mol ca(oh) 2 = m × v = 0,1 mol/liter × 0,1 liter = 0,01 mol [2] satu mol larutan natrium hidroksida (naoh) direaksikan dengan 1 mol larutan asam sulfat (h 2 so 4 ) sesuai reaksi: Memilih pereaksi yang digunakan sebagai pembatas dan yang berlebih.
 Source: dictio.id
Source: dictio.id
Reaksi antara 9 mol h 2 a dengan 2 mol b(oh) 3 yang menghasilkan b 2 a 3 dan h 2 o. Posting pada kimia ditag 01 * 10 24 atom ni, 5 mol h2o, apa yang dimaksud dengan kesetimbangan kimia, apa yang dimaksud dengan pereaksi pembatas, berapa banyak mol hcl, berapa gram massa 3 mol besi, berapa komposisi persentase massa heksana, buatlah peta konsep bab stoikiometri, buku kimia dasar stoikiometri, buku tentang stoikiometri, cara. Di bidang kimia kita tahu dengan nama pereaksi zat yang bertanggung jawab untuk menghasilkan reaksi kimia. [2] satu mol larutan natrium hidroksida (naoh) direaksikan dengan 1 mol larutan asam sulfat (h 2 so 4 ) sesuai reaksi:
Apa yang dimaksud dengan pereaksi pembatas.
Dalam sebuah wadah tertutup, 20 gram metana (ch 4) dibakar dengan 64 gram oksigen (o 2) menghasilkan karbon dioksida dan uap air menurut reaksi dibawah. Massa air yang dihasilkan = n x mr h 2 o = 1,5 x 18 = 27 gram. Pereaksi pembatas dan pereaksi berlebih dalam reaksi kimia dapat ditemukan ketika kita mereaksikan dua zat atau lebih, namun ada salah satu zat yang habis terlebih dahulu. Pereaksi tersebut kemudian merupakan unsur kimia yang. Dan produk yang terbentuk dibatasi oleh pereaksi ini, dan reaksi tidak mungkin terjadi tanpa pereaksi pembatas.
 Source: oktavianirini38.blogspot.com
Source: oktavianirini38.blogspot.com
Untuk mengetahui dan menghitung hubungan kuantitatif suatu reaksi kita perlu memahami tentang konsep mol. Stoikiometri ialah ilmu yang mempelajari dan menghitung hubungan kuantitatif reaktan dan produk dalam reaksi kimia. 0,5 mol n2 direaksikan dengan 3 mol h2 menurut reaksi: Oleh karena itu, kita perlu mengetahui cara menentukan pereaksi pembatas dalam reaksi kimia. Jumlah pereaksi pembaas menentukan seberapa banyak jumlah zat hasil reaksi, sehingga dalam melakukan perhitungan pada reaksi kimia, kita harus menentukan terlebih dahulu pereaksi.
Pereaksi yang habis bereaksi (pereaksi pembatas) adalah pereaksi yang jumlah molnya terkecil, yaitu h 2.
Jika zat lain yang bereaksi masih ada sisa setelah bereaksi dengan pereaksi pembatas, maka zat tersebut disebut sebagai pereaksi berlebih (excess reactant). Sementara itu, klasifikasi yang paling benar tergantung pada karakteristik penggunaan yang ditunjukkan untuk pereaksi yang dimaksud, oleh karena itu, pereaksi akan diklasifikasikan dengan benar sesuai dengan penggunaan yang dimaksudkan. Ca(oh) 2 (aq) + 2 hcl(aq) → cacl 2 (aq) + 2 h 2 o(l) tentukan pereaksi pembatas! Mol ca(oh) 2 = m × v = 0,1 mol/liter × 0,1 liter = 0,01 mol
 Source: dictio.id
Source: dictio.id
Apa yang dimaksud dengan pereaksi pembatas jelaskan beserta contohnya? Mol ca(oh) 2 = m × v = 0,1 mol/liter × 0,1 liter = 0,01 mol Pereaksi yang habis bereaksi (pereaksi pembatas) adalah pereaksi yang jumlah molnya terkecil, yaitu h 2. Pereaksi pembatas (limiting reactant) = zat pereaksi yang habis bereaksi lebih dahulu, dan menjadi penentu jumlah produk yang dihasilkan.
 Source: brainly.co.id
Source: brainly.co.id
Massa pereaksi sisa (o 2) = n x mr o 2 = 0,5 x 32 = 16 gram Jika selesihnya 0 (jumlah zat awal = jumlah zat bereaksi) inilah yang sebagai pereaksi pembatas. Tahukah kamu apa yang dimaksud dengan reaksi kimia? [2] satu mol larutan natrium hidroksida (naoh) direaksikan dengan 1 mol larutan asam sulfat (h 2 so 4 ) sesuai reaksi:
 Source: dictio.id
Source: dictio.id
Zat yang habis terlebih dahulu itu dinamakan sebagai pereaksi pembatas dan zat yang tidak sepenuhnya habis bereaksi dinamakan pereaksi berlebih.untuk lebih jelasnya, perhatikan. Dan produk yang terbentuk dibatasi oleh pereaksi ini, dan reaksi tidak mungkin terjadi tanpa pereaksi pembatas. 1) dan salah satu reaktan hadir dalam jumlah. Yang dimaksud dengan pereaksi pembatas adalah pereaksi (reaktan) yang habis bereaksi dan tidak tersisa di akhir reaksi.
Massa pereaksi sisa (o 2) = n x mr o 2 = 0,5 x 32 = 16 gram
Pereaksi pembatas adalah pereaksi yang habis lebih dulu dalam sebuah reaksi kimia. Sedangkan pereaksi berlebih (excess) = pereaksi yang jumlahnya melebihi dari jumlah yang dibutuhkan. 100 ml larutan ca(oh) 2 0,1 m direaksikan dengan 100 ml larutan hcl 0,1 m sesuai reaksi: Reaksi antara 9 mol h 2 a dengan 2 mol b(oh) 3 yang menghasilkan b 2 a 3 dan h 2 o. Mol na 2 so 4 yang dihasilkan = 0,5 mol mol h 2 so 4 yang dihasilkan = 1 mol 2.
 Source: blog.ruangguru.com
Memilih pereaksi yang digunakan sebagai pembatas dan yang berlebih. Di bidang kimia kita tahu dengan nama pereaksi zat yang bertanggung jawab untuk menghasilkan reaksi kimia. Zat yang habis terlebih dahulu itu dinamakan sebagai pereaksi pembatas dan zat yang tidak sepenuhnya habis bereaksi dinamakan pereaksi berlebih.untuk lebih jelasnya, perhatikan. Oleh karena itu, kita perlu mengetahui cara menentukan pereaksi pembatas dalam reaksi kimia. Diketahui mr metana = 16, ar oksigen = 16, dan mr h 2 o = 18.
Mol na 2 so 4 yang dihasilkan = 0,5 mol mol h 2 so 4 yang dihasilkan = 1 mol 2.
Pereaksi yang habis bereaksi (pereaksi pembatas) adalah pereaksi yang jumlah molnya terkecil, yaitu h 2. Sebelum membahas lebih lanjut, mari perhatikan daftar isi berikut. Stoikiometri ialah ilmu yang mempelajari dan menghitung hubungan kuantitatif reaktan dan produk dalam reaksi kimia. [2] satu mol larutan natrium hidroksida (naoh) direaksikan dengan 1 mol larutan asam sulfat (h 2 so 4 ) sesuai reaksi:
 Source: oktavianirini38.blogspot.com
Source: oktavianirini38.blogspot.com
Massa air yang dihasilkan = n x mr h 2 o = 1,5 x 18 = 27 gram. Volume gas co 2 dihasilkan = n x 22,4 liter = 1 x 22,4 = 22,4 liter. Ca(oh) 2 (aq) + 2 hcl(aq) → cacl 2 (aq) + 2 h 2 o(l) tentukan pereaksi pembatas! Pereaksi pembatas dan pereaksi berlebih dalam reaksi kimia dapat ditemukan ketika kita mereaksikan dua zat atau lebih, namun ada salah satu zat yang habis terlebih dahulu.
 Source: dictio.id
Source: dictio.id
Pereaksi yang sisa adalah h 2 so 4 c. Dan produk yang terbentuk dibatasi oleh pereaksi ini, dan reaksi tidak mungkin terjadi tanpa pereaksi pembatas. Ca(oh) 2 (aq) + 2 hcl(aq) → cacl 2 (aq) + 2 h 2 o(l) tentukan pereaksi pembatas! Dalam sebuah wadah tertutup, 20 gram metana (ch 4) dibakar dengan 64 gram oksigen (o 2) menghasilkan karbon dioksida dan uap air menurut reaksi dibawah.
 Source: dictio.id
Source: dictio.id
Pereaksi yang sisa adalah h 2 so 4 c. Mol ca(oh) 2 = m × v = 0,1 mol/liter × 0,1 liter = 0,01 mol Pereaksi yang sisa adalah h 2 so 4 c. N 2 (g) + 3 h 2 (g).
Pereaksi yang berlebih adalah reaktan yang tidak sepenuhnya habis digunakan selama reaksi kimia, dengan kata lain ada beberapa dari reaktan yang tersisa setelah reaksi.
Pereaksi pembatas (limiting reactant) = zat pereaksi yang habis bereaksi lebih dahulu, dan menjadi penentu jumlah produk yang dihasilkan. Di bidang kimia kita tahu dengan nama pereaksi zat yang bertanggung jawab untuk menghasilkan reaksi kimia. Pereaksi tersebut kemudian merupakan unsur kimia yang. Pereaksi pembatas adalah zat pereaksi yang habis lebih dahulu dalam suatu reaksi kimia. N 2 (g) + 3 h 2 (g).
 Source: brainly.co.id
Source: brainly.co.id
0,5 mol n2 direaksikan dengan 3 mol h2 menurut reaksi: Oleh karena itu, kita perlu mengetahui cara menentukan pereaksi pembatas dalam reaksi kimia. Volume gas co 2 dihasilkan = n x 22,4 liter = 1 x 22,4 = 22,4 liter. Pereaksi pembatas adalah pereaksi yang habis lebih dulu dalam sebuah reaksi kimia. Sebelum membahas lebih lanjut, mari perhatikan daftar isi berikut.
Zat yang habis terlebih dahulu itu dinamakan sebagai pereaksi pembatas dan zat yang tidak sepenuhnya habis bereaksi dinamakan pereaksi berlebih.untuk lebih jelasnya, perhatikan.
Massa pereaksi sisa (o 2) = n x mr o 2 = 0,5 x 32 = 16 gram 0,5 mol n2 direaksikan dengan 3 mol h2 menurut reaksi: Jumlah pereaksi pembaas menentukan seberapa banyak jumlah zat hasil reaksi, sehingga dalam melakukan perhitungan pada reaksi kimia, kita harus menentukan terlebih dahulu pereaksi. Pereaksi pembatas (limiting reactant) = zat pereaksi yang habis bereaksi lebih dahulu, dan menjadi penentu jumlah produk yang dihasilkan.
 Source: dictio.id
Source: dictio.id
Stoikiometri ialah ilmu yang mempelajari dan menghitung hubungan kuantitatif reaktan dan produk dalam reaksi kimia. Reaksi antara 9 mol h 2 a dengan 2 mol b(oh) 3 yang menghasilkan b 2 a 3 dan h 2 o. Apa yang dimaksud dengan pereaksi pembatas. [2] satu mol larutan natrium hidroksida (naoh) direaksikan dengan 1 mol larutan asam sulfat (h 2 so 4 ) sesuai reaksi: Massa air yang dihasilkan = n x mr h 2 o = 1,5 x 18 = 27 gram.
 Source: dictio.id
Source: dictio.id
Jumlah pereaksi pembaas menentukan seberapa banyak jumlah zat hasil reaksi, sehingga dalam melakukan perhitungan pada reaksi kimia, kita harus menentukan terlebih dahulu pereaksi. Mol ca(oh) 2 = m × v = 0,1 mol/liter × 0,1 liter = 0,01 mol Penggunaan yang dimaksudkan reagen mudah ditemukan, karena biasanya ditunjukkan pada wadah reagen yang. Pereaksi yang sisa adalah h 2 so 4 c. Oleh karena itu, jumlah mol nh 3 dihitung berdasarkan jumlah mol h 2.
 Source: blog.ruangguru.com
Sesuai namanya, pereaksi pembatas akan membatasi jumlah produk yang dapat dihasilkan. Pereaksi tersebut kemudian merupakan unsur kimia yang. Untuk mengetahui dan menghitung hubungan kuantitatif suatu reaksi kita perlu memahami tentang konsep mol. 100 ml larutan ca(oh) 2 0,1 m direaksikan dengan 100 ml larutan hcl 0,1 m sesuai reaksi: Pereaksi yang sisa adalah h 2 so 4 c.
Situs ini adalah komunitas terbuka bagi pengguna untuk mencurahkan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini bagus, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul apa yang dimaksud dengan pereaksi pembatas dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.